- ホーム
- 製品基本情報-製品一覧
- デファイテリオ®静注200mg
- 製品情報概要-臨床成績
- 海外第Ⅲ相試験(2005-01試験)
海外第Ⅲ相試験(2005-01試験)1)、2)
HSCT後の重症肝類洞閉塞症候群(SOS)患者を対象としたHC対照オープンラベル試験(海外データ)
- HSCT:造血幹細胞移植
- HC:ヒストリカルコントロール
- 出典
-
- 海外第Ⅲ相:HSCT後重症SOS患者を対象としたHC対照オープンラベル試験(2005-01)(承認時評価資料)
利益相反:本試験はGentium社(現在はJazz社の子会社)のサポートにより行われた。 - Richardson PG, et al. Blood 2016;127:1656-1665
利益相反:本論文の著者にJazz社の社員が含まれる。
- 海外第Ⅲ相:HSCT後重症SOS患者を対象としたHC対照オープンラベル試験(2005-01)(承認時評価資料)
海外第Ⅲ相試験(動画)
HSCT後の重症SOS患者を対象としたヒストリカルコントロール対照オープンラベル試験(海外データ)
-
試験方法
目的 重症SOS患者(多臓器不全(MOF)を伴うSOS患者)におけるデファイテリオ®の有効性について、HSCT後100日生存をHC*1群と比較することで証明する。 対象 Baltimore基準*2に適合し、MOFを併発している重症SOS*3患者102例。
HC*1群:32例用法・用量 デファイテリオ®は1回6.25mg/kgを1日4回、1回あたり2時間以上かけて静脈内投与し、投与間隔は6時間ごととした(1日投与量:25mg/kg/日)。デファイテリオ®は5%ブドウ糖注射液で最高濃度4mg/mLに希釈した。 治療期間 デファイテリオ®群の被験者は、組み入れ基準に適合後、可能な限り速やかに1回目の投与を開始した。
少なくとも21日間投与し、事情の許す限り、被験者が退院するまで治療を継続することとした。
退院して本剤の投与を終了し、その後SOSが再発した場合は、再入院し前回と同様の用法・用量で治療を再開することとした。評価項目 -
(1)有効性
- 1)主要評価項目:HSCT後100日生存
-
2)副次評価項目:
- HSCT後100日までの寛解*4
- HSCT後180日生存
- 全生存
-
(2)安全性
解析計画 Intention to treat(ITT)を主要解析対象集団とした。 -
(1)有効性
有効性の主要な解析には、傾向スコアを用いた。傾向スコアで層別し、重み付けした生存率又は寛解率の差の推定値について、Koch法を用いて両側95.1%信頼区間及び両側P値を算出した。<傾向スコアの算出に用いた予後に影響を与える因子>
人工呼吸器又は透析依存(あり/なし)、年齢(16歳以下/超)、移植の種類(同種/自家)、幹細胞移植歴(あり/なし)
-
(2)安全性
有害事象、臨床検査、バイタルサイン及び診察を通じて安全性を確認した。
デファイテリオ®群は試験組み入れ日から最終投与後30日までに発現した事象を有害事象とした。
HC群は、MOFを伴う重症SOSと診断された日から退院後30日又はHSCT後100日のいずれか早い時点までに発現した事象を有害事象とみなした。
-
*1:HC群の選択
治験登録施設でHSCTを受けた患者6,867例から各施設のスクリーニングにより、Baltimore基準を満たす重症SOS患者123例が選択された。これらの患者の転帰情報を含まないデータから、医師による独立審査委員会が選択・除外基準を満たす被験者を選別し、32例が抽出された。
-
*2:Baltimore基準
HSCT後21日までの黄疸(ビリルビン≧2mg/dL)
かつ以下の臨床所見のうち2項目以上を満たす
腹水
ベースラインa)から5%を超える体重増加
- 肝腫大
もともと肝腫大を合併していた患者では、肝臓サイズがベースラインb)より増大していることが検診又は画像検査によって証明されている
- a)前処置1日目の体重(値が入手できなかった場合、HSCTユニットに入室した日の体重を使用可能)
- b)HSCTユニットに入室した時点
-
*3:重症SOSの定義
HSCT後28日までに、以下のMOF症状のうち1項目以上を満たす
臓器 項目 基準 腎機能 血清クレアチニン ベースラインa)の3倍を超える クレアチニンクリアランス又は
推定糸球体濾過量(eGFR)ベースラインb)の40%未満 透析 必要とする 肺機能 酸素飽和度 90%未満(少なくとも1時間間隔で2回測定)c) - a) 前処置のためにHSCTユニットへ入室した日の値又はHSCT前処置期間の最低値(いずれか低い方)
- b) HSCTユニットへ入室した日
- c) 2回目の酸素飽和度の測定値が得られなかった場合、1回の測定値が<90%又は酸素吸入/人工呼吸器を必要とする場合で可とした。肺機能障害は、体液過剰又は腹部膨満や肝腫大による機械的圧迫に起因するものとし、感染(肺炎など)が原因となるものは除く。
-
*4:寛解基準
総ビリルビン2mg/dL未満
以下の全てに該当
臓器 項目 基準 腎機能 血清クレアチニン ベースライン又は年齢調整した基準値上限の1.5倍未満 クレアチニンクリアランス又はeGFR ベースラインの80%を超える 透析 必要としない 肺機能 酸素飽和度 90%を超える 酸素吸入 必要としない 人工呼吸管理 必要としない
-
-
患者背景

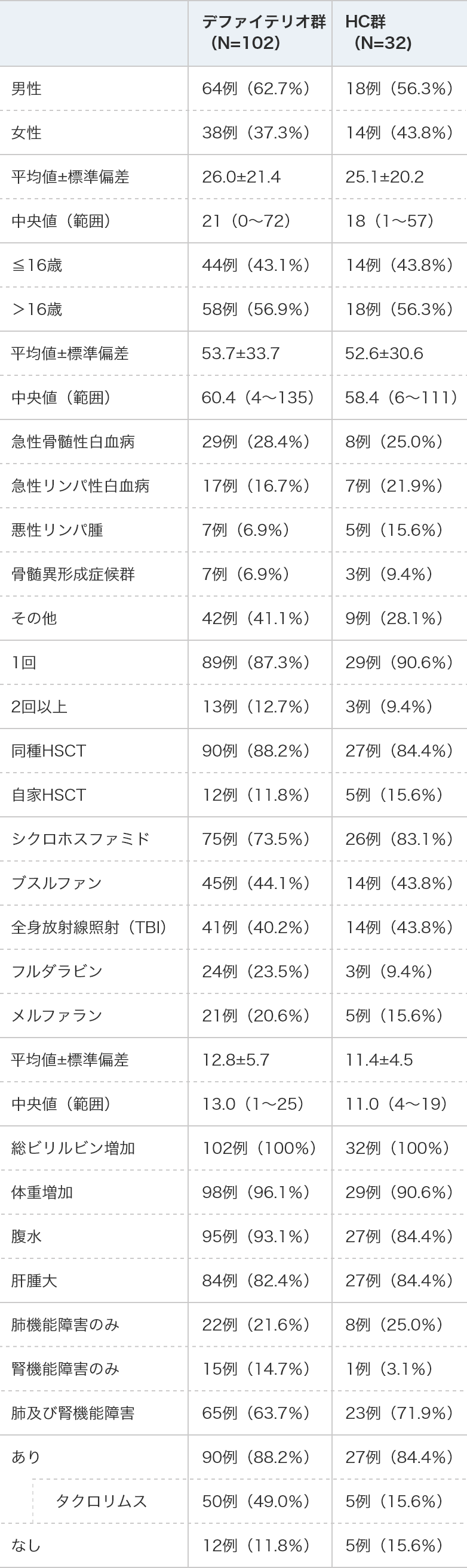
デファイテリオ®群
(N=102)HC群
(N=32)性別 男性 64例(62.7%)
18例(56.3%)
女性 38例(37.3%)
14例(43.8%)
年齢(歳) 平均値±標準偏差 26.0±21.4 25.1±20.2 中央値(範囲) 21(0~72)
18(1~57)
年齢分布 ≦16歳 44例(43.1%)
14例(43.8%)
>16歳 58例(56.9%)
18例(56.3%)
体重(kg) 平均値±標準偏差 53.7±33.7 52.6±30.6 中央値(範囲) 60.4(4~135)
58.4(6~111)
原疾患 急性骨髄性白血病 29例(28.4%)
8例(25.0%)
急性リンパ性白血病 17例(16.7%)
7例(21.9%)
悪性リンパ腫 7例( 6.9%)
5例(15.6%)
骨髄異形成症候群 7例( 6.9%)
3例( 9.4%)
その他 42例(41.1%)
9例(28.1%)
HSCT回数 1回 89例(87.3%)
29例(90.6%)
2回以上 13例(12.7%)
3例( 9.4%)
移植の種類 同種HSCT 90例(88.2%)
27例(84.4%)
自家HSCT 12例(11.8%)
5例(15.6%)
移植前処置
(抜粋)シクロホスファミド 75例(73.5%)
26例(83.1%)
ブスルファン 45例(44.1%)
14例(43.8%)
全身放射線照射(TBI) 41例(40.2%)
14例(43.8%)
フルダラビン 24例(23.5%)
3例( 9.4%)
メルファラン 21例(20.6%)
5例(15.6%)
HSCT施行から
SOS診断までの日数(日)平均値±標準偏差 12.8±5.7 11.4±4.5 中央値(範囲) 13.0(1~25)
11.0(4~19)
SOS基準 総ビリルビン増加 102例(100%)
32例(100%)
体重増加 98例(96.1%)
29例(90.6%)
腹水 95例(93.1%)
27例(84.4%)
肝腫⼤ 84例(82.4%)
27例(84.4%)
重症SOS診断 肺機能障害のみ 22例(21.6%)
8例(25.0%)
腎機能障害のみ 15例(14.7%)
1例( 3.1%)
肺及び腎機能障害 65例(63.7%)
23例(71.9%)
GVHD予防薬
(登録時)あり 90例(88.2%)
27例(84.4%)
タクロリムス 50例(49.0%)
5例(15.6%)
なし 12例(11.8%)
5例(15.6%)
-
有効性
デファイテリオ®群102例(投与期間中央値:21.5日(範囲:1~58日))とHC群32例を比較した。21日以上投与を継続した患者は102例中59例(57.8%)であった。なお、寛解到達患者26例の投与期間中央値は、22日(範囲:14~56日)であった。
HSCT後100日生存(主要評価項目)
HSCT後100日の生存率は、デファイテリオ®群で38.2%、HC群で25.0%であった。傾向スコアで層別し、重み付けした生存率の群間差の推定値は23.0%(95.1%信頼区間:5.2%~40.8%、P=0.0109、Koch法)であり、重症SOS患者において、本剤投与によりHC群よりもHSCT後100日生存率を改善することが示された。
重症SOS患者におけるHSCT後100日までのKaplan-Meier生存曲線

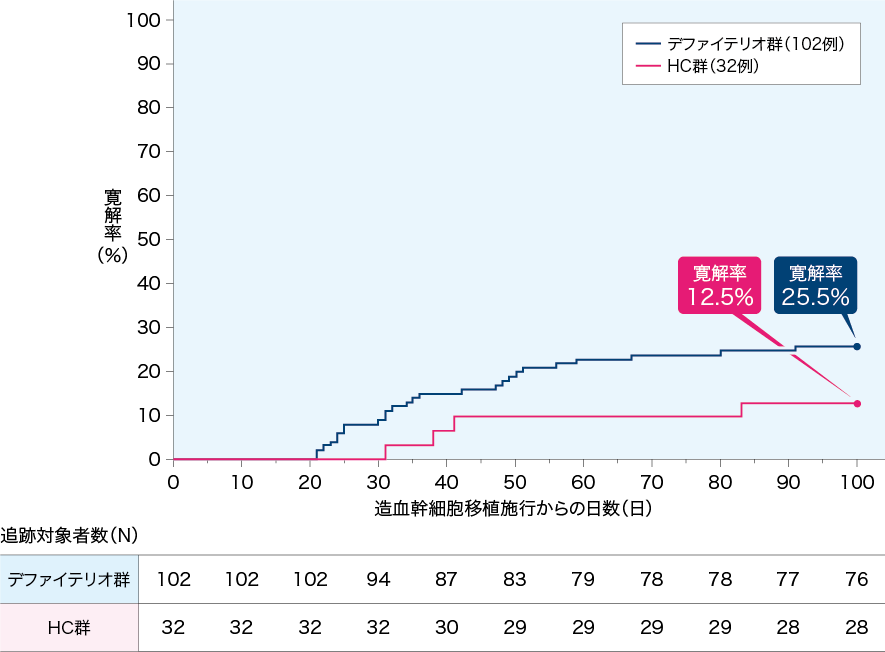
HSCT後100日までの寛解(副次評価項目)
HSCT後100日までの寛解率はデファイテリオ®群で25.5%(26例/102例)、HC群で12.5%(4例/32例)であった。傾向スコアで層別し、重み付けした寛解率の群間差の推定値は19.0%(95.1%信頼区間:3.5%~34.6%、P=0.016、Koch法)であり、重症SOS患者において、本剤投与によりHC群よりもHSCT後100日までの寛解率を改善することが示された。また、HSCT後100日までに寛解に到達した症例の寛解到達期間の中央値はデファイテリオ®群で34.5日、HC群で39.5日であった。
HSCT後100日までの寛解
-
安全性
デファイテリオ®群において102例中46例(45.1%)で副作用*1が発現した。
デファイテリオ®群における主な副作用は、肺胞出血、鼻出血、低血圧 各7例(6.9%)、胃腸出血、処置後出血 各5例(4.9%)であった。重篤な副作用*2 肺胞出血6例(5.9%)、肺出血、胃腸出血、脳出血、カテーテル留置部位出血、凝血異常 各2例(2.0%)、低血圧、血便排泄、メレナ、穿刺部位出血、処置後出血、くも膜下出血、鼻出血、血胸、胸部出血、出血 各1例(1.0%) 投与中止に至った
副作用肺胞出血、カテーテル留置部位出血 各3例(2.9%)、肺出血、脳出血 各2例(2.0%)、低血圧、凝血異常、胃腸出血、血便排泄、上部消化管出血、処置後出血、頭痛、鼻出血、胸部出血、出血 各1例(1.0%) 死亡に至った副作用 肺胞出血5例(4.9%)、脳出血2例(2.0%)、胃腸出血、くも膜下出血、出血 各1例(1.0%) - *1:治験薬との因果関係が「関連あり」、「おそらく関連あり」、「関連あるかもしれない」と判定された有害事象
- *2:死亡転帰を含む
デファイテリオ®群において102例中99例(97.1%)、HC群において32例中32例(100%)で有害事象が発現した。
安全性結果の概要
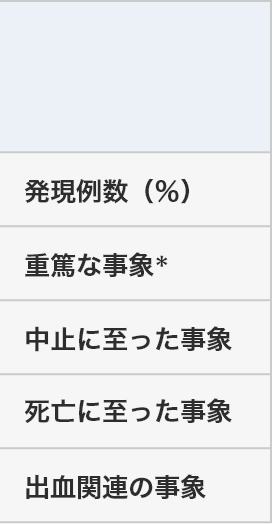
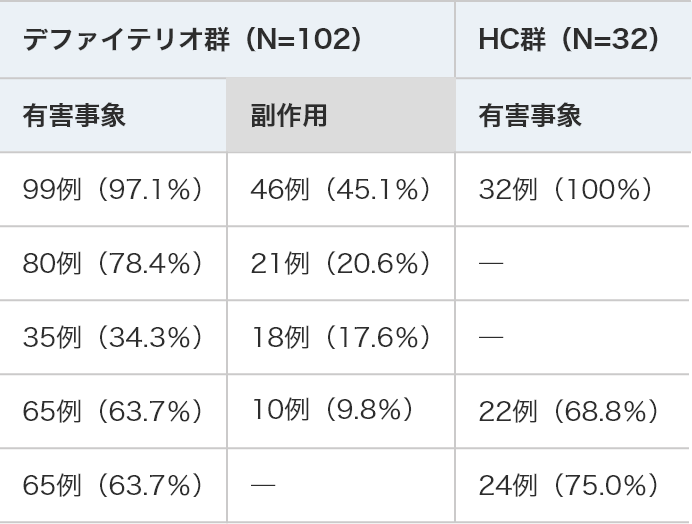
デファイテリオ®群(N=102) HC群(N=32) 有害事象 副作用 有害事象 発現例数(%) 99例(97.1%) 46例(45.1%) 32例(100%) 重篤な事象* 80例(78.4%) 21例(20.6%) ― 中止に至った事象 35例(34.3%) 18例(17.6%) ― 死亡に至った事象 65例(63.7%) 10例( 9.8%) 22例(68.8%) 出血関連の事象 65例(63.7%) ― 24例(75.0%) *死亡転帰を含む
―:未集計
主な有害事象(デファイテリオ®群で10%以上に発現)及び副作用

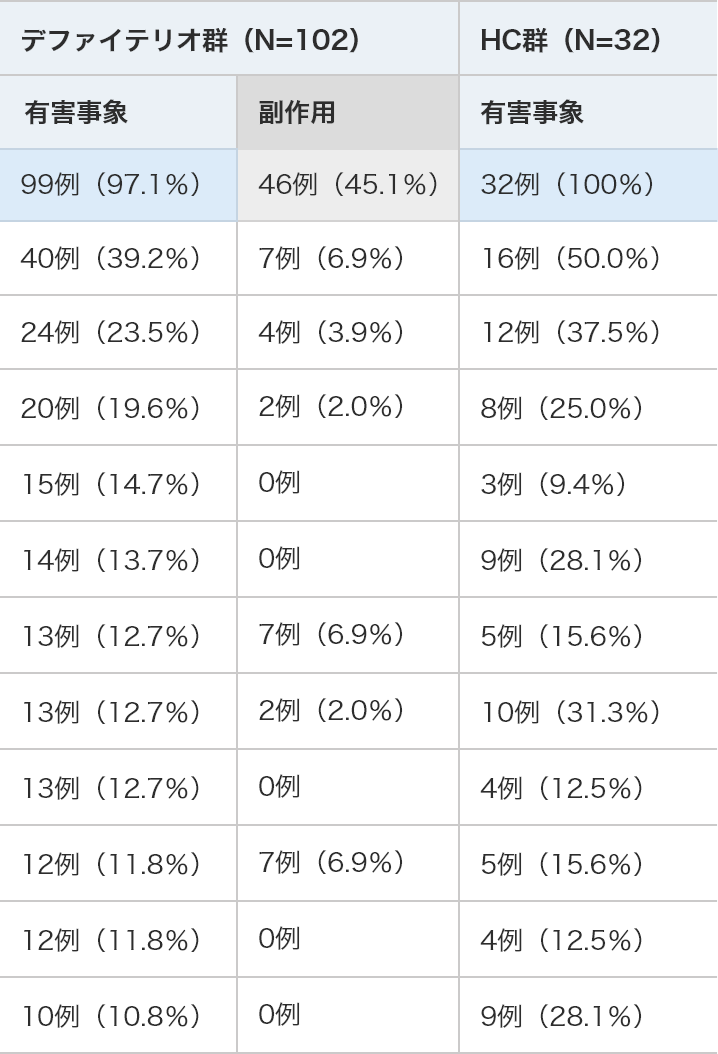
デファイテリオ®群(N=102) HC群(N=32) 有害事象 副作用 有害事象 発現例数(%) 99例(97.1%) 46例(45.1%) 32例(100%) 低血圧 40例(39.2%) 7例( 6.9%) 16例( 50.0%) 下痢 24例(23.5%) 4例( 3.9%) 12例(37.5%) 嘔吐 20例(19.6%) 2例( 2.0%) 8例(25.0%) 多臓器不全 15例(14.7%) 0例 3例(9.4%) 発熱 14例(13.7%) 0例 9例(28.1%) 鼻出血 13例(12.7%) 7例( 6.9%) 5例(15.6%) 悪心 13例(12.7%) 2例( 2.0%) 10例(31.3%) 末梢性浮腫 13例(12.7%) 0例 4例(12.5%) 肺胞出血 12例(11.8%) 7例( 6.9%) 5例(15.6%) 呼吸不全 12例(11.8%) 0例 4例(12.5%) 激越 11例(10.8%) 0例 9例(28.1%) MedDRA ver.16.0により集計
-
補足情報:除外基準、デファイテリオ®投与中止・再開基準
海外第Ⅲ相試験(2005-01試験)による除外基準
海外第Ⅲ相試験(2005-01試験) 抗凝固薬 【デファイテリオ®群の除外基準】
- 出血のリスクを増大させる薬剤を使用している
- 12時間以内にヘパリン又は他の抗凝固薬を使用している
ルーチンの中心静脈ライン管理、中心静脈ライン閉塞に対するフィブリン溶解剤の点滴、間欠的透析又は持続的静脈血液濾過(CVVH)の限外濾過のための使用は許容する
急性出血 下記の臨床的に重要なコントロールされていない急性出血のいずれかに該当する - 失血を補充するために>15cc/kgの濃厚赤血球を要する出血
- HSCT日から重症SOSの診断日までのいずれかの時点において、失血量に関係なく治験責任医師が生命を脅かす可能性があると判断した部位からの出血
(例:肺出血又はCNS出血)
- 臨床的に重要なコントロールされていない急性出血でなければ(透析目的又は血液希釈のためなど)、上記記載量の輸血は許容する
血行動態 - 複数の昇圧剤を必要とするような血行動態が不安定、又は単一の昇圧剤では平均動脈圧の維持が困難
- 小児:平均動脈圧を年齢で調節した水準の1標準偏差内に維持することができない
- 1種類の昇圧剤を投与中の患者は、8時間以上平均動脈圧(MAP)が安定していなければならない
- Renal dose のドパミン(2~5μg/kg/分)単独を要する患者は、MAPの測定値がなくても適格とする
肝炎 - HSCT施行時点で肝硬変と診断されている
- 重症SOS基準に適合した時点で、腹水、体重増加、黄疸の症状を示す疾患として劇症ウイルス性肝炎などの代替診断がついている
GVHD International Bone Marrow Transplant Registry(IBMTR)のGVHD重症度指数において、肝又は消化管でグレードB~D、又は皮膚でグレードC以上と診断されている 移植歴 固形臓器移植歴がある その他 - HSCT前及び/又はHSCT施行時点で入院透析を実施している、又はHSCT前処置中に酸素吸入を実施している
- 症状緩和のための一時的な酸素吸入は除外しない
【HC群の除外基準】
- SOSに対してデファイテリオ®治療歴がある
海外第Ⅲ相試験(2005-01試験)におけるデファイテリオ®投与中止基準
及び投与再開基準- 投与中止:
- Grade 3又は4の有害事象(本剤と関連あり/おそらく関連あり/関連あるかもしれない)が発現した場合
臨床的に重大な(急性)出血※1が発現した場合
- 投与再開:
- 一度は本剤の再投与を検討しても良い。
ただし、有害事象により本剤の投与が連続して8回実施されなかった場合は、以降、本剤の再投与は認めない。※2
また、Grade 3又は4の有害事象が再度認められた場合には、本剤の投与を中止する。
-
※1:
臨床的に重大な(急性)出血の定義
15cc/kgを超える濃厚赤血球輸血を必要とする出血他に、以下項目も臨床的に重大な(急性)出血として考慮する。例)
● 体重20kgの小児患者においては、300cc/kgを超える濃厚赤血球輸血を24時間以内に必要とする。
● 体重70kgの成人患者においては、3単位を超える濃厚赤血球輸血を24時間以内に必要とする。
※海外における1単位は一般的に全血400~500mLに相当します。また、赤血球製剤1ccあたりの全血量は国によって異なります。
- ● 医師の判断
- ● 血行動態不安定によって引き起こされる出血
- ● 生命を脅かす出血(肺胞出血や中枢神経系出血など)
また、デスモプレシン(DDAVP)を投与する場合は適切な管理の下、投与すること。
他に、外科的治療や感染症治療、ビタミンKの補充など適切な処置を施し、本剤の再投与を試みること。 -
※2:
「本剤の投与が連続して8回実施されなかった場合は、以降、本剤の再投与は認めない」の基準は、臨床試験においてデファイテリオ®の有効性を判定するために設けられました。実臨床下では有害事象により本剤の投与が連続して8回実施されなかった場合でも治療上の有益性を考慮し、本剤の再投与が必要と判断した場合は、再投与を行ってください。