- トップ
- 製品基本情報-製品一覧
- デファイテリオ®静注200mg
- 適正使用ガイド-重大な副作用とその対策
重大な副作用とその対策
-
1 ショック、アナフィラキシー
- ショック、アナフィラキシー及び過敏症があらわれることがあります。
- 本剤による治療期間中は、患者の状態を十分に観察してください。
- 重度の過敏症反応が発現した場合は、本剤の投与を中止し、適切な処置を行ってください。
また、症状が消失するまでモニタリングを実施してください。
症状
初期症状 : 蕁麻疹、嘔吐、血圧低下、虚脱、意識消失など
発現状況
-
アナフィラキシー
臨床試験では、本剤投与群においてアナフィラキシーは認められませんでした。 -
過敏症
海外拡大アクセス試験(2006-05試験)において、副作用として薬物過敏症、過敏症が1,154例中各1例(0.1%)に認められました。いずれもGrade 2であり、本剤投与を継続し、回復しました。
-
2 出血
- 本剤は凝固・線溶系の各種因子に影響すると考えられ、本剤投与により出血リスクが増加し、重篤な出血があらわれることがあります。
- 造血幹細胞移植後のSOS患者では、移植前処置に伴う血小板減少による出血があらわれることがあります。また、化学療法及び大量放射線療法後のSOS患者でも、出血リスクが増加するおそれがあります。
- 本剤と血栓溶解剤は、出血の危険性が増大するおそれがあるため併用禁忌です。
- 本剤と抗凝固薬や抗血小板薬等を併用する場合は注意が必要です(臨床試験において、出血リスクを増大させる薬剤の併用は禁止されていました)。
- 異常が認められ、本剤による有効性が評価できない場合には、直ちに投与を中止し、適切な処置を行ってください。出血の原因疾患の治療及び出血が認められなくなるまで対症療法を行ってください。
発現状況
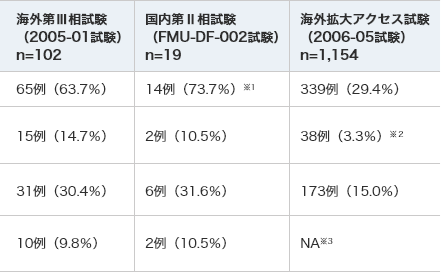
臨床試験別の出血関連有害事象の発現率
臨床試験で高頻度(10%以上)に発現した出血関連の有害事象は、肺出血、肺胞出血、鼻出血、胃腸出血、出血、血尿、出血性膀胱炎、血胸でした。
臨床試験別の出血関連有害事象の発現率
海外第Ⅲ相試験
(2005-01試験)
N=102国内第Ⅱ相試験
(FMU-DF-002試験)
N=19海外拡大アクセス試験
(2006-05試験)
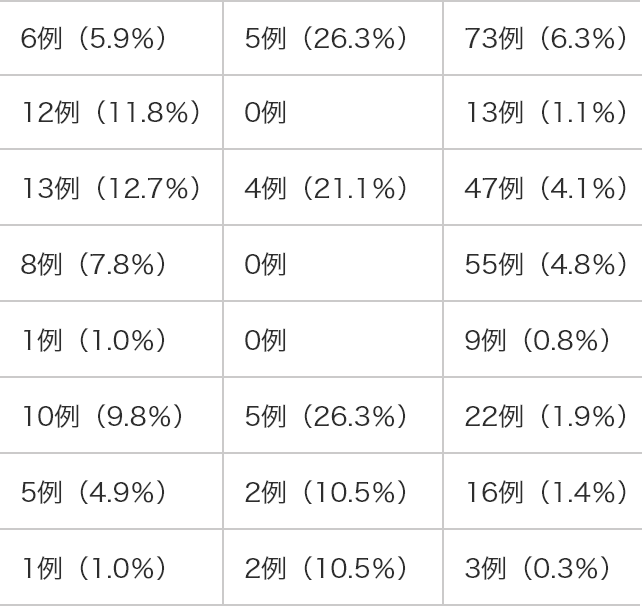
N=1,154出血関連の有害事象 65例(63.7%) 14例(73.7%)※1 339例(29.4%) 死亡に至った出血関連の有害事象 15例(14.7%) 2例(10.5%) 38例(3.3%)※2 出血関連の重篤な有害事象 31例(30.4%) 6例(31.6%) 173例(15.0%) 死亡に至った出血関連の副作用 10例(9.8%) 2例(10.5%) NA※3 いずれかの試験においてデファイテリオ群で高頻度(10%以上)に発現した出血関連の有害事象 肺出血 6例(5.9%) 5例(26.3%) 73例(6.3%) 肺胞出血 12例(11.8%) 0例 13例(1.1%) 鼻出血 13例(12.7%) 4例(21.1%) 47例(4.1%) 胃腸出血 8例(7.8%) 0例 55例(4.8%) 出血 1例(1.0%) 0例 9例(0.8%) 血尿 10例(9.8%) 5例(26.3%) 22例(1.9%) 出血性膀胱炎 5例(4.9%) 2例(10.5%) 16例(1.4%) 血胸※4 1例(1.0%) 2例(10.5%) 3例(0.3%) 
いずれかの試験においてデファイテリオ群で高頻度(10%以上)に発現した出血関連の有害事象

- 集計に用いた用語はMedDRA/J ver.19.1に準拠
- ※1:国内第Ⅱ相試験(FMU-DF-002試験)では、活性化部分トロンボプラスチン時間延長 2例(10.5%)、血中フィブリノゲン減少、国際標準比増加、皮膚剥脱 各1例(5.3%)も含む
- ※2:Grade 5の出血関連有害事象
- ※3:NA:該当なし
- ※4:MedDRA ver.16.0/PTの「胸腔内出血」を含む
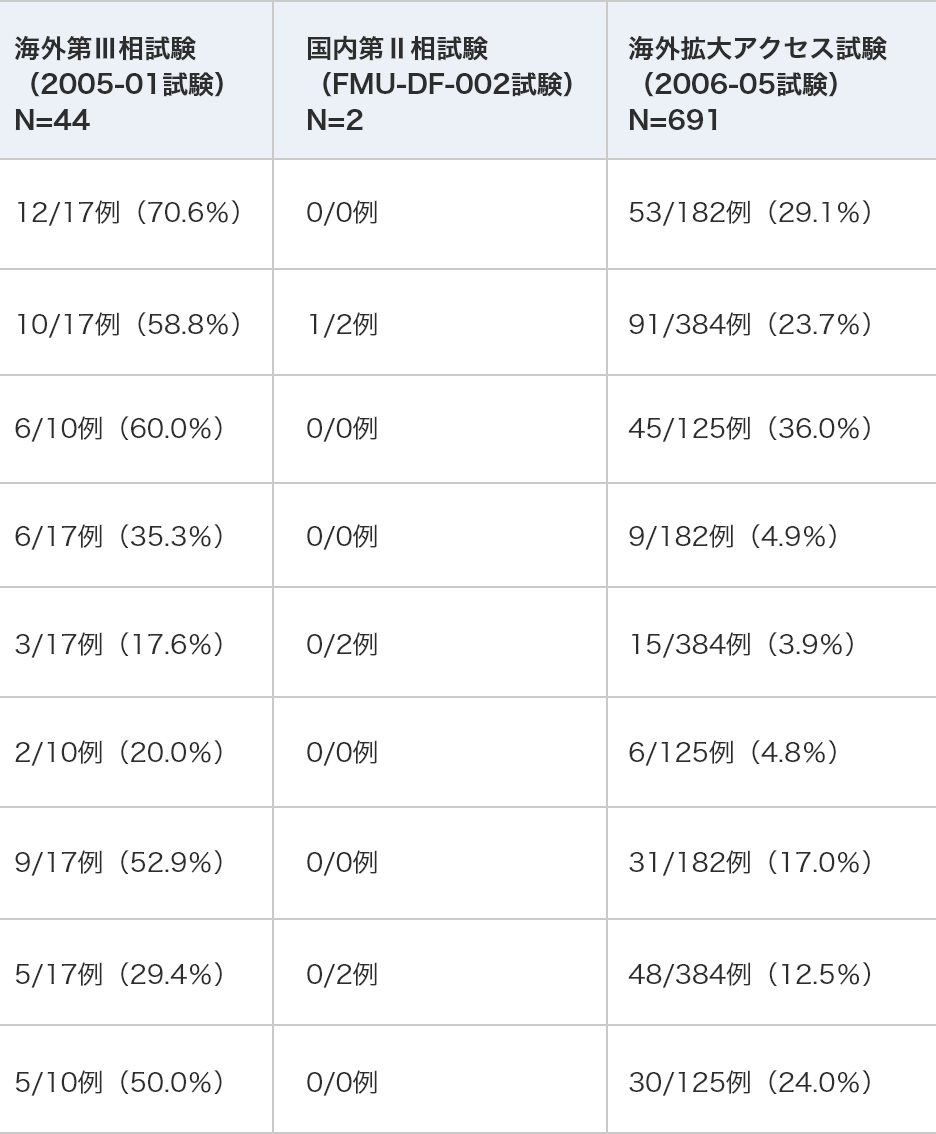
小児における出血関連の有害事象
臨床試験での小児における出血関連の有害事象発現例数及び発現率を以下に示します。
小児における出血関連の有害事象
海外第Ⅲ相試験
(2005-01試験)
N=44国内第Ⅱ相試験
(FMU-DF-002試験)
N=2海外拡大アクセス試験
(2006-05試験)
N=691出血関連の
有害事象新生児/乳児(0-23ヵ月) 12/17例(70.6%) 0/0例 53/182例(29.1%) 幼児(2-11歳) 10/17例(58.8%) 1/2例 91/384例(23.7%) 小児(12-16歳) 6/10例(60.0%) 0/0例 45/125例(36.0%) 死亡に至った
出血関連の
有害事象新生児/乳児(0-23ヵ月) 6/17例(35.3%) 0/0例 9/182例(4.9%) 幼児(2-11歳) 3/17例(17.6%) 0/2例 15/384例(3.9%) 小児(12-16歳) 2/10例(20.0%) 0/0例 6/125例(4.8%) 重篤な
出血関連の
有害事象新生児/乳児(0-23ヵ月) 9/17例(52.9%) 0/0例 31/182例(17.0%) 幼児(2-11歳) 5/17例(29.4%) 0/2例 48/384例(12.5%) 小児(12-16歳) 5/10例(50.0%) 0/0例 30/125例(24.0%) 
海外第Ⅲ相試験(2005-01試験)のデファイテリオ群(小児)に発現した出血関連の有害事象

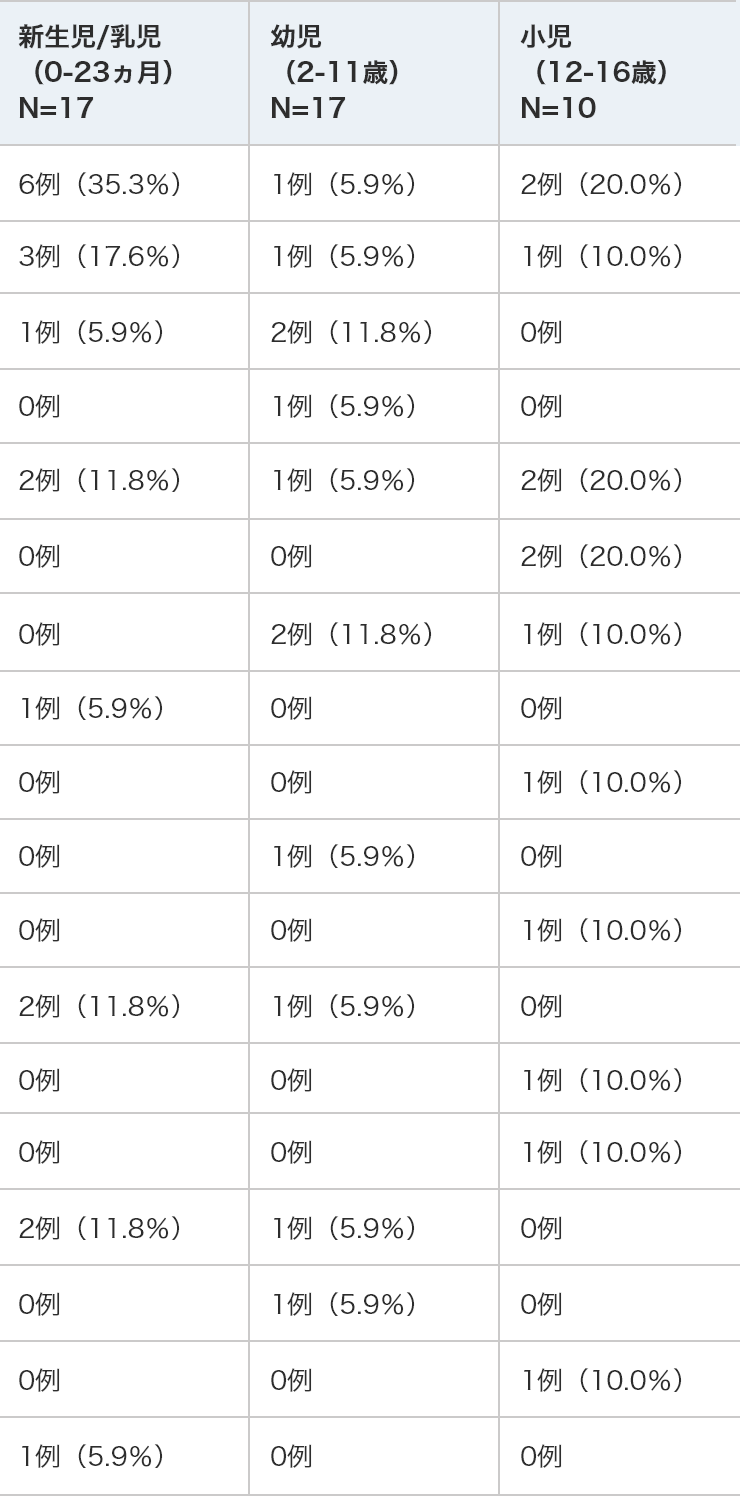
新生児/乳児
(0-23ヵ月)
N=17幼児
(2-11歳)
N=17小児
(12-16歳)
N=10肺胞出血 6例(35.3%) 1例(5.9%) 2例(20.0%) 肺出血 3例(17.6%) 1例(5.9%) 1例(10.0%) 胃腸出血 1例(5.9%) 2例(11.8%) 0例 出血 0例 1例(5.9%) 0例 血尿 2例(11.8%) 1例(5.9%) 2例(20.0%) 出血性膀胱炎 0例 0例 2例(20.0%) 結膜出血 0例 2例(11.8%) 1例(10.0%) 強膜出血 1例(5.9%) 0例 0例 口腔内出血 0例 0例 1例(10.0%) 上部消化管出血 0例 1例(5.9%) 0例 穿刺部位出血 0例 0例 1例(10.0%) 処置後出血 2例(11.8%) 1例(5.9%) 0例 眼窩周囲出血 0例 0例 1例(10.0%) 気管出血 0例 0例 1例(10.0%) 頭蓋内出血 2例(11.8%) 1例(5.9%) 0例 脳出血 0例 1例(5.9%) 0例 くも膜下出血 0例 0例 1例(10.0%) 咽頭出血 1例(5.9%) 0例 0例 - 集計に用いた用語はMedDRA ver.16.0に準拠
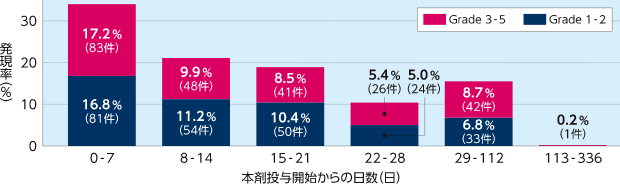
出血関連の有害事象の時期別発現件数及び発現率
特に、本剤投与後2週間以内は出血関連の有害事象に注意してください。
海外第Ⅲ相試験(2005-01試験)
出血関連の有害事象の発現率(7日ごと)
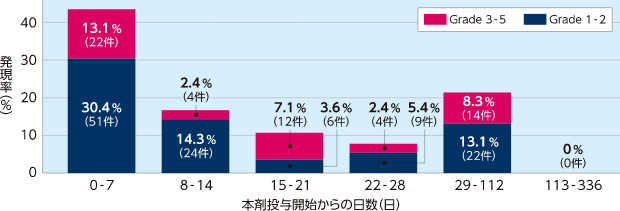
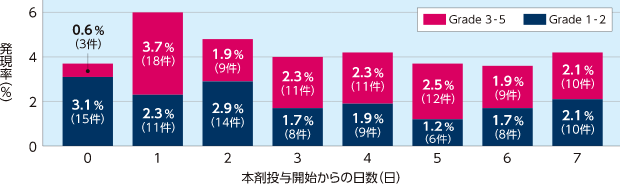
投与開始1週目の出血関連の有害事象の発現率
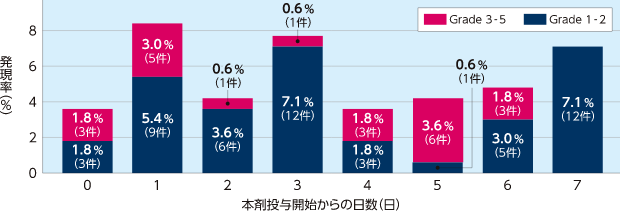
国内第Ⅱ相試験(FMU-DF-002試験)
出血関連の有害事象の発現率(7日ごと)
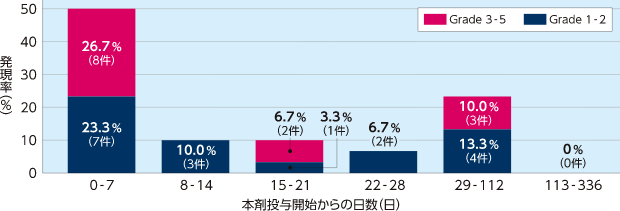
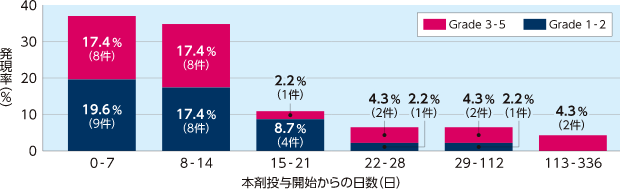
海外拡大アクセス試験(2006-05試験)
HSCT後SOS患者における出⾎関連の有害事象の発現率(7日ごと)
HSCT後SOS患者における投与開始1週目の出血関連の有害事象の発現率
化学療法後SOS患者における出血関連の有害事象の発現率(7日ごと)
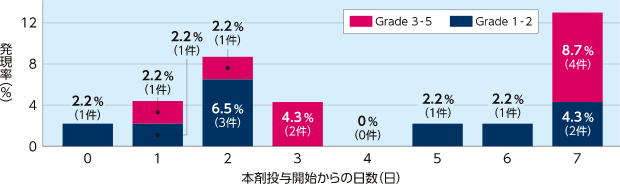
化学療法後SOS患者における投与開始1週目の出血関連の有害事象の発現率
-
3 低血圧
- 低血圧があらわれることがあります。
- 本剤による治療期間中は、患者の状態を十分に観察してください。
- 異常が認められ、本剤による有効性が評価できない場合には、直ちに投与を中止し、昇圧剤の投与などの適切な処置を行ってください。
- なお、海外第Ⅲ相試験(2005-01試験)、国内第Ⅱ相試験(FMU-DF-002試験)では、平均動脈圧の維持に複数の昇圧剤を必要とする患者は除外されていました。
各臨床試験における低血圧関連の有害事象及び副作用
海外第Ⅲ相試験
(2005-01試験)国内第Ⅱ相試験
(FMU-DF-002試験)
N=19海外拡大アクセス試験
(2006-05試験)
N=1,154デファイテリオ群
N=102HC群※
N=32死亡に至った
低血圧有害事象 0例 0例 0例 10例 (0.9%) 副作用 0例 0例 0例 2例 (0.2%) 重篤な低血圧 有害事象 14例 (13.7%) - 0例 46例 (4.0%) 副作用 1例 (1.0%) - 0例 7例 (0.6%) 投与中止に
至った低血圧有害事象 3例 (2.9%) - 1例 (5.3%) 16例 (1.4%) 副作用 1例 (1.0%) - 0例 5例 (0.4%) 
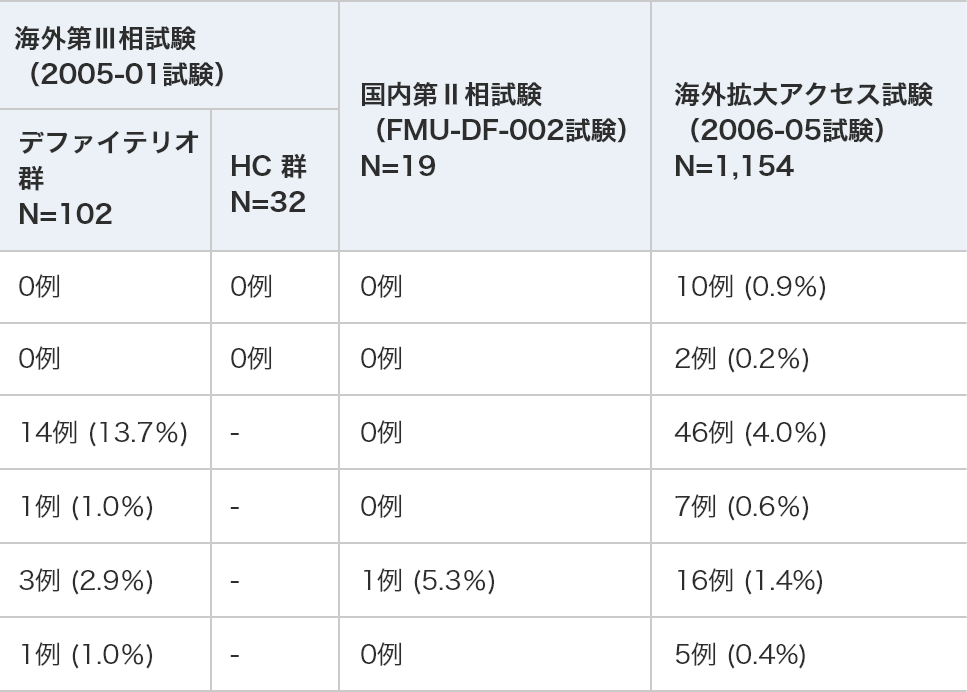
※HC群:ヒストリカルコントロール群