外国人デュシェンヌ型筋ジストロフィー(DMD)患者を対象とした海外第Ⅱ相試験:用量設定試験※[NS-065/NCNP-01-201](海外データ)4)
※用量設定試験のため一部承認外の成績が含まれています。
4)日本新薬株式会社 社内資料(承認時評価資料):外国人DMD患者を対象とした海外第Ⅱ相試験(COI:本試験はNS Pharma,Inc.の支援により実施された。)
※用量設定試験のため一部承認外の成績が含まれています。
4)日本新薬株式会社 社内資料(承認時評価資料):外国人DMD患者を対象とした海外第Ⅱ相試験(COI:本試験はNS Pharma,Inc.の支援により実施された。)
-
試験概要
目的 - 歩行可能なDMD患者を対象に、ビルトラルセン40又は80 mg/kgを週1回、20又は24週間静脈内投与した際の有効性、安全性及び薬物動態を評価する。
- ビルトラルセンによる筋力、可動性、運動機能に与える影響を自然歴群(DNHS:Duchenne natural history study)と比較する。
対象 エクソン53スキッピングにより治療可能なジストロフィン遺伝子の欠失が確認されている男性DMD男性患者16例(年齢:4歳以上10歳未満、歩行可能:16例)
[選択基準]
- 同意取得時に4歳以上かつ投与開始時に10歳未満
- 補助機器なしで独立歩行可能
- スクリーニング時に「床からの立ち上がり時間」、「10 m歩行/走行時間」及び「4段階段昇り時間」を実施できることが確認されている
- スクリーニング時の臨床検査値が標準範囲内であるか、異常の場合は治験責任医師により臨床的に意義のない異常であると評価されている
- 少なくとも試験組入れの3ヵ月前からグルココルチコイド(GC)の用量を変更せず、試験期間中も変更の予定がないこと
自然歴の選択 自然歴群は米国の筋ジストロフィー臨床試験ネットワーク、cooperative international neuromuscular research group(CINRG)が実施したDNHSのベースライン時のデータに基づき選択した。CINRG DNHSは、約440名のDMD男性患者を対象とした自然歴研究であり、ベースライン時、1年目に4回、2年目に2回、以降は年1回の最長10年間にわたって各来院時にデータ取得が行われた(2006~2016年)。評価項目として、時間機能検査、筋力検査、アンケートによる機能検査、肺機能検査、QOLが設定された。
NS-065/NCNP-01-201試験はCINRGに所属する施設によって実施され、SOP及び臨床評価者訓練プロトコルは両試験間で一致させた。CINRG DNHSから、NS-065/NCNP-01-201試験の年齢、ステロイド使用状況及び地域等の主要な登録基準を含む以下の基準を満たす患者を選択した。その結果、DMD男性患者65例が基準を満たし、そのうち、9例はエクソン53スキッピング治療対象の患者、56例はそれ以外の患者であった。[選択条件]
- ベースライン時の10 m歩行/走行時間、床からの立ち上がり時間及び4段階段昇り時間のデータを含む、少なくとも12ヵ月の時間機能検査データがある。
- ベースライン時に4歳以上10歳未満
- 北アメリカ(米国又はカナダ)
- ベースライン時にコルチコステロイドを少なくとも3ヵ月間投与しており、12〜24ヵ月の観察期間を通して継続して使用している。
- 他のエクソンスキッピング薬の臨床試験に登録していない。
- 遺伝子検査の結果、重複変異、ナンセンス変異又はフレームシフトを引き起こす変異をもつ患者も含める。
[除外条件]
- プロモーターからエクソン8の間に変異がある患者
- エクソン44スキッピング治療の対象となる患者
- インフレーム変異を持つ患者
- リーディングフレーム内に変異が存在するか同定できない患者
試験デザイン 多施設共同、自然歴対照の用量設定試験
Period 1(4週間):無作為化、二重盲検、プラセボ対照
Period 2(20週間):オープンラベル
本試験は、低用量コホート(40 mg/kg群)及び高用量コホート(80 mg/kg群)共に、3:1でランダムに割り付けられた実薬又はプラセボを4週間投与する二重盲検期(Period 1)と、全被験者に各コホートの実薬を20週間投与するオープンラベル期(Period 2)により構成した。Period 2終了後、希望する被験者は継続投与試験(NS-065/NCNP-01-202)に参加することができ、参加しない場合は30日の追跡期間(フォローアップ)を設けた。
なお、高用量コホートの投与は、低用量コホートの全被験者がPeriod 1を終了し、安全性が確認された後に開始した。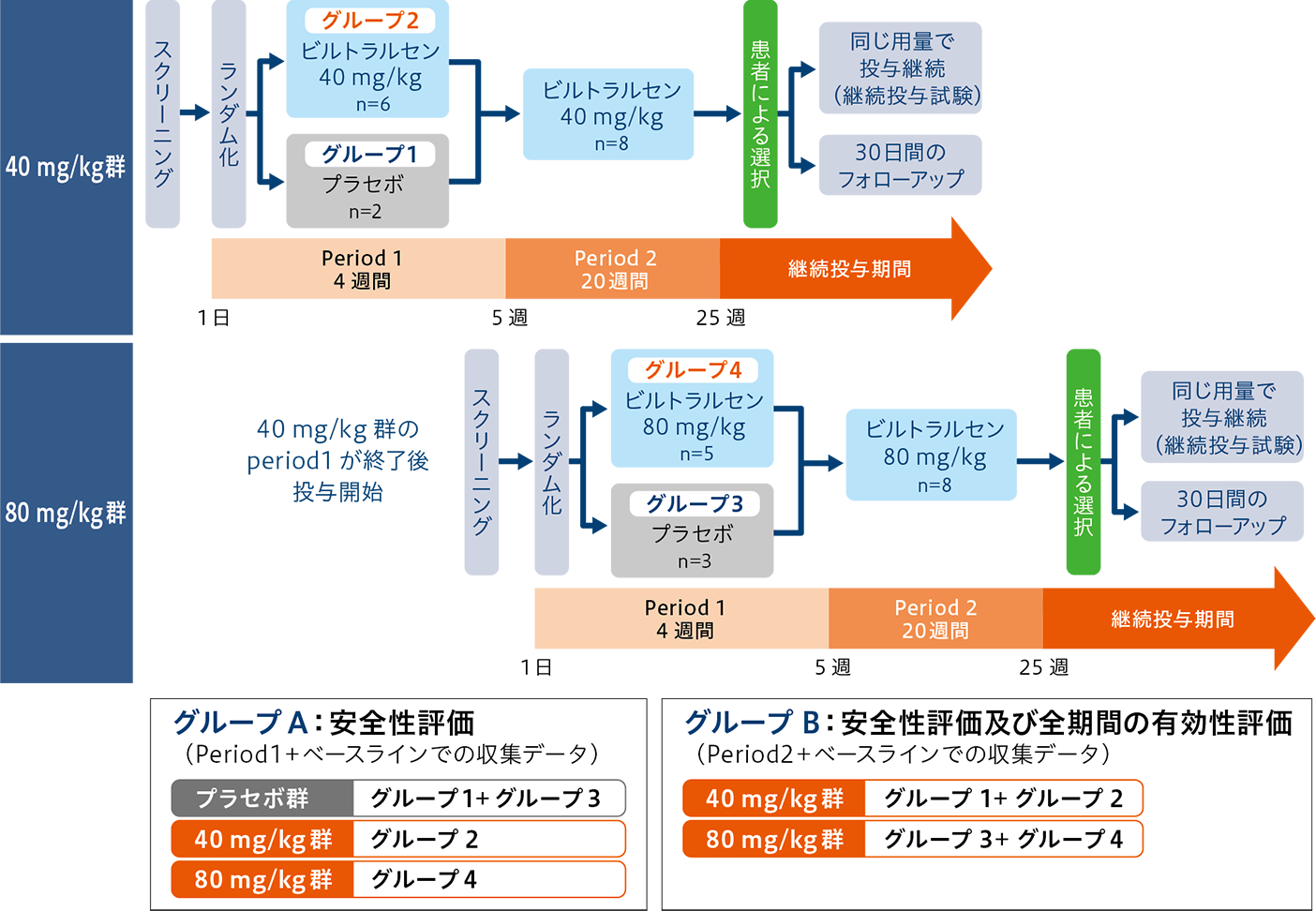
投与方法 ビルトラルセン40 mg/kg又は80 mg/kg(濃度:25 mg/mL)を、1時間かけて週1回静脈内投与した。 主要評価項目 ジストロフィンの発現(ウェスタンブロット法) 副次評価項目 - ジストロフィンの発現とエクソン53スキッピング効率
- ジストロフィンの発現(免疫蛍光染色)
- ジストロフィンの発現(質量分析)
- エクソン53スキッピング効率(RT-PCR)
- 運動機能評価
- 時間機能検査(10 m歩行/走行時間、床からの立ち上がり時間、6分間歩行距離、4段階段昇り時間、ノース・スター歩行能力評価)
- 定量的筋力検査
その他の
評価項目- 安全性
- 薬物動態
解析計画 -
解析対象集団
- 安全性解析対象集団:
- 治験薬を1回以上投与された全ての被験者とした。実際に投与された投与群で解析を行った。
- 有効性解析対象集団:
- 治験薬を1回以上投与され、ベースライン及びベースライン後に1つ以上の有効性評価を有する被験者をmITT(modified intention to treat)とした。mITTは割り付けられた投与群で解析を行った。
- 薬物動態解析対象集団:
- 治験薬を1回以上投与され、1つ以上の血漿中濃度測定値を有する被験者とした。
|グループA|
プラセボを最初に4週間投与される被験者4例(グループ1、グループ3)、40 mg/kgを24週間投与される被験者6例(グループ2)及び80 mg/kgを24週間投与される被験者6例(グループ4)の比較として計画した。
しかし実際は、プラセボ群5例(グループ1が2例、グループ3が3例)、40 mg/kg群6例(グループ2)、80 mg/kg群5例(グループ4)であった。グループAは、最初の4週間での安全性パラメータの変化を要約することを目的とした。グループAの解析ではPeriod 1(+ベースライン)に収集したデータのみが含まれた。
|グループB|
2つの用量群(グループ1+2、グループ3+4)でグループ化し、最初の4週間を除く全ての安全性評価及び全ての期間の有効性評価に適用された。グループBの解析ではPeriod 2(+ベースライン)に収集したデータのみが含まれた。
有効性評価及び安全性評価のベースラインは、初回投与日(1日目)の治験薬投与前の最後の測定と定義した。
-
有効性
主要評価項目のジストロフィンの発現(ウェスタンブロット法)について、グループBの各用量群の被験者内変化を、対応のあるt検定で検定し、次に対応のないt検定を用いて2用量群間の変化量を比較した。さらにグループBの全被験者について、被験者内変化を対応のあるt検定を用いて検定した。
副次評価項目のジストロフィンの発現(免疫蛍光染色、質量分析)、エクソン53スキッピング効率についても同様に解析を行った。
時間機能検査については、床からの立ち上がり時間、4段階段昇り時間及び10 m歩行/走行時間の結果を速度に変換し、時間及び速度の結果を記述的に提示した。定量的筋力検査では、各検査についてvisitごとに利き手、非利き手及び両側の高値で解析した。
時間機能検査及び定量的筋力検査の変化量について、グループBの各用量群の被験者内変化を対応のあるt検定で検定し、対応のないt検定を用いて2用量群間の変化量を比較した。
さらにグループBの全被験者について、被験者内変化を対応のあるt検定を用いて検定した。なお、速度への変換においては、変換前の値が疾患進行に伴って欠測した場合、最初に生じた来院時のみ0とし、それ以降は欠測とした。
時間機能検査及び定量的筋力検査の結果を、CINRG DNHSの患者集団(n=65)の結果と比較した。床からの立ち上がり時間、4段階段昇り時間、10 m歩行/走行時間、6分間歩行距離、ノース・スター歩行能力評価及び定量的筋力検査の結果について、試験又は自然歴データ、評価時点、試験又は自然歴データと評価時点の交互作用を因子とし、年齢とベースライン値を共変量とした反復測定混合モデル解析(MMRM:mixed model for repeated measures)を行った。
これらの有効性評価指標は、グループBの各用量群及び全患者とCINRG DNHSの3つのコホートを比較し、線形混合効果モデルによる最小二乗平均(LSM)、95%CI及びp値を用いて検討した。
検定はいずれも両側とし、p値が≦0.05となる差を統計学的に有意であるとみなした。
多重性の調整は行わず、多重検定法も実施しなかった。
-
安全性
有害事象、臨床検査、バイタルサイン及び12誘導心電図の各visitにおける記述統計量を投与群別に算出した。抗体検査(抗ジストロフィン抗体、抗ビルトラルセン抗体)については、各visitにおける陰性/陽性の結果を要約した。
[用法及び用量]通常、ビルトラルセンとして80 mg/kgを週1回、1時間かけて静脈内投与する。
-
患者背景
ベースライン時の人口統計学的特性
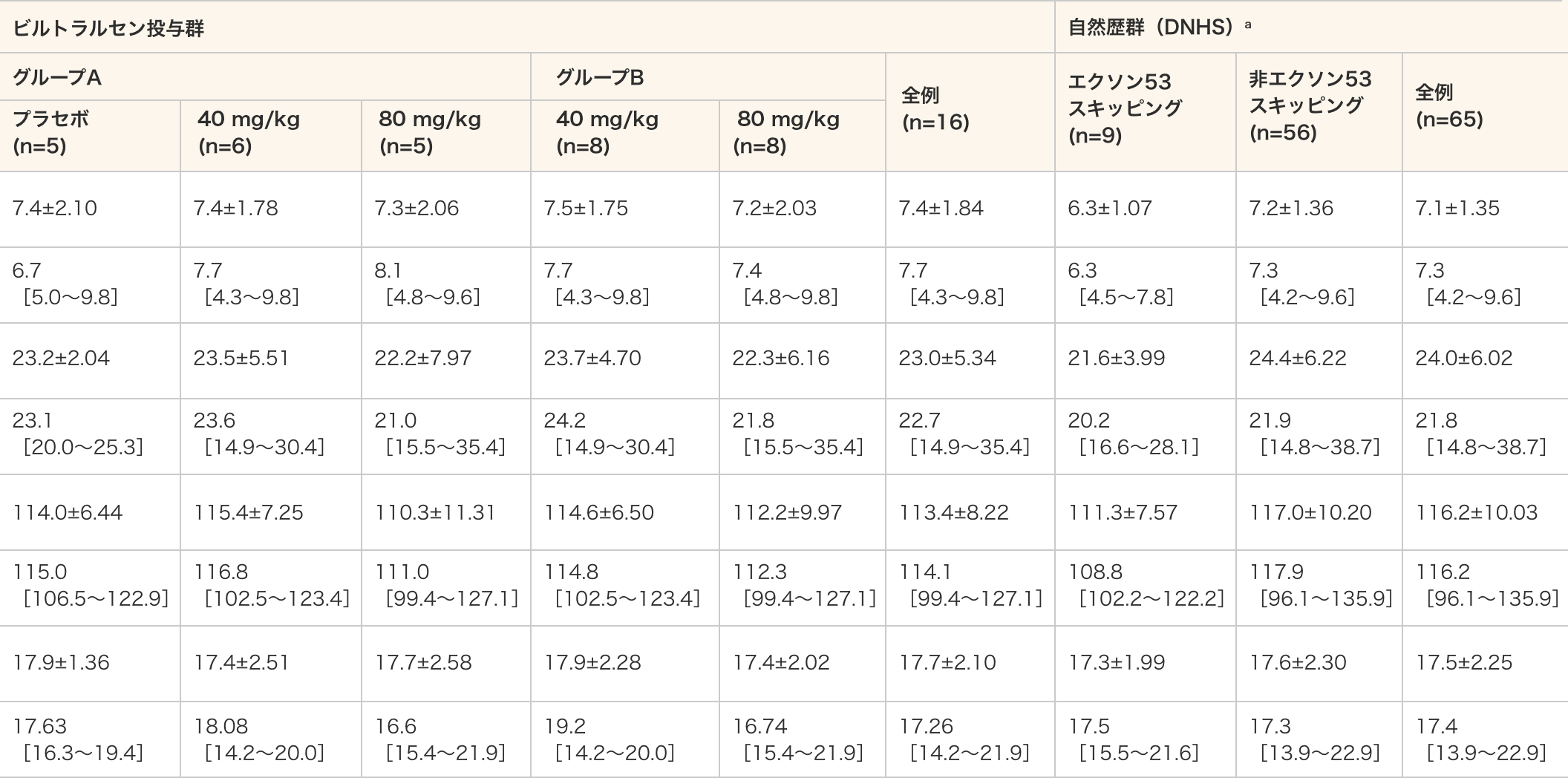
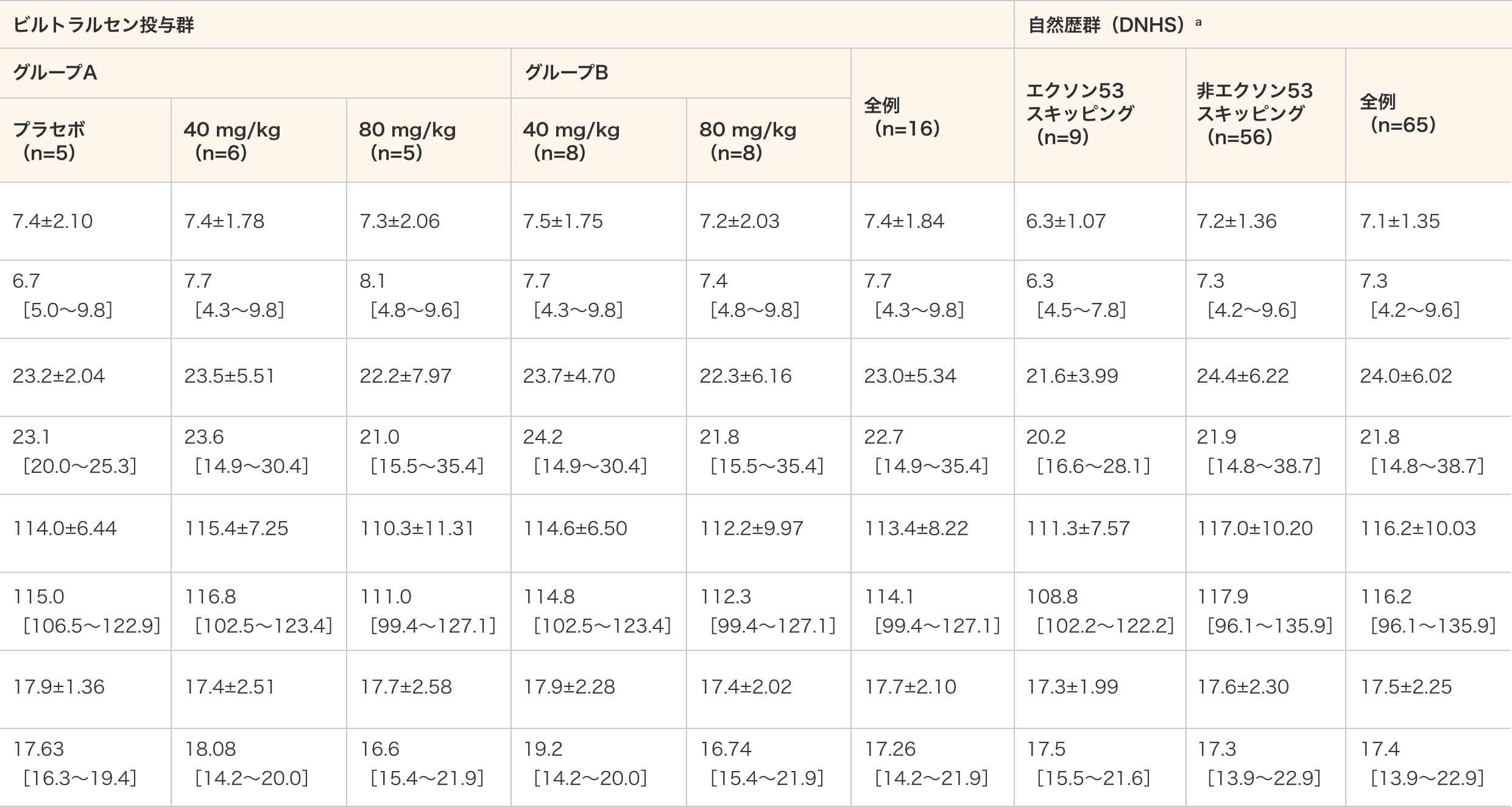
- a:DNHSのエクソン53スキッピング群はエクソン53スキッピング治療対象のDMD患者、非エクソン53スキッピング群はエクソン53スキッピング治療対象でないDMD患者を意味する。
ベースライン時の疾患特性(ビルトラルセン投与群)
40 mg/kg(n=8) 80 mg/kg(n=8) 全例(n=16) エクソンの欠失部位
n(%)43〜52 0 0 0 45〜52 2(25.0) 5(62.5) 7(43.8) 47〜52 1(12.5) 0 1(6.3) 48〜52 1(12.5) 2(25.0) 3(18.8) 49〜52 2(25.0) 1(12.5) 3(18.8) 50〜52 2(25.0) 0 2(12.5) 52 0 0 0 歩行可能 n(%) 8(100) 8(100) 16(100) グルココルチコイドの使用状況 n(%) 8(100) 8(100) 16(100) - 自然歴群(DNHS)65例の遺伝子変異内訳を以下のとおり示す。
- ・エクソン53スキッピング治療 対象患者:9例
- 内訳:単一エクソン欠失3例、複数エクソン欠失6例
- ・エクソン53スキッピング治療 非対象患者:56例
- 内訳:単一エクソン欠失4例、複数エクソン欠失30例、単一エクソン重複3例、複数エクソン重複3例、その他の変異16例
徴候及び症状の要約

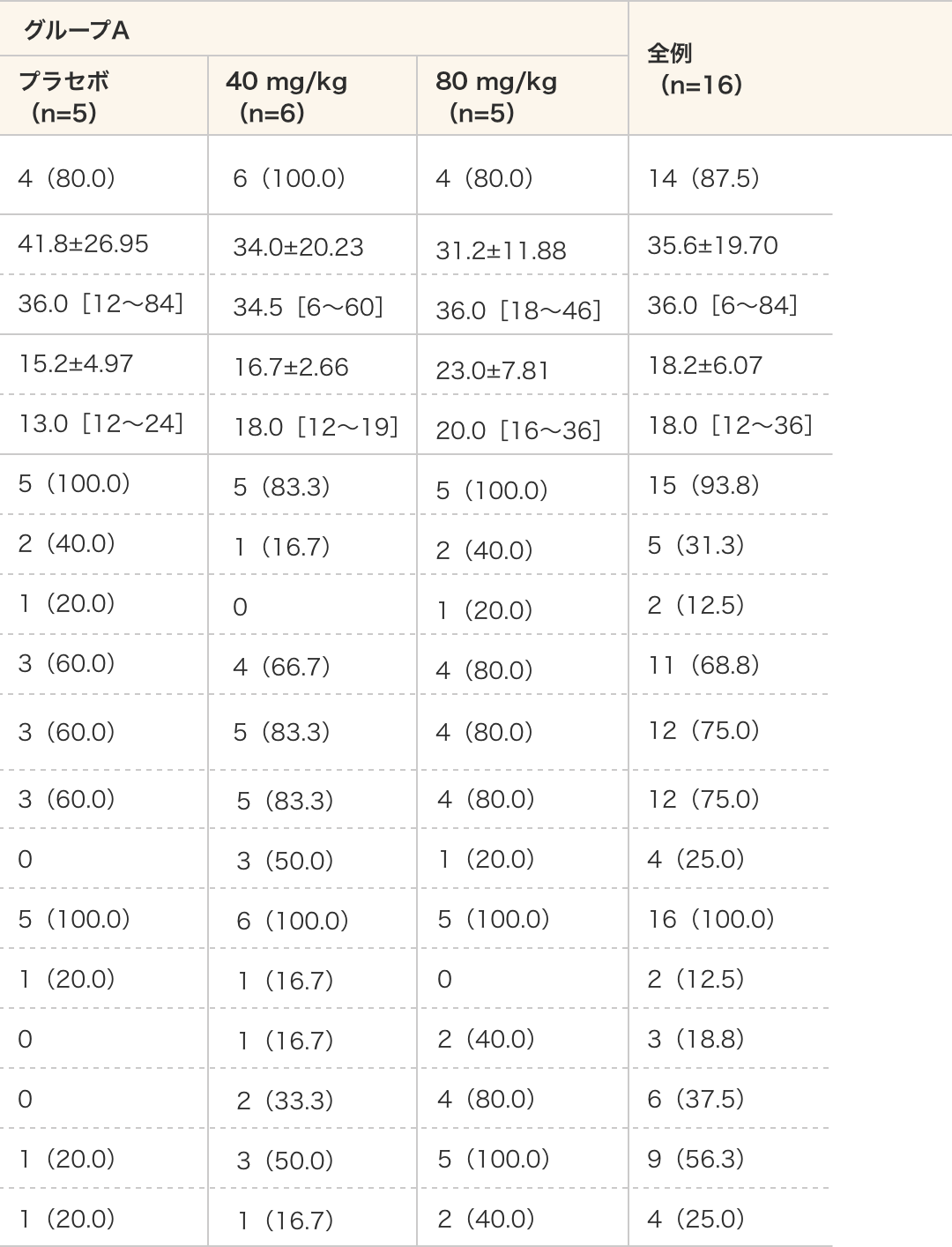
グループA 全例(n=16) プラセボ(n=5) 40 mg/kg(n=6) 80 mg/kg(n=5) 診断時にDMDの徴候又は症状あり n(%) 4(80.0) 6(100.0) 4(80.0) 14(87.5) 最初に徴候又は症状が確認された月齢(月) 平均値±標準偏差 41.8±26.95 34.0±20.23 31.2±11.88 35.6±19.70 中央値[範囲] 36.0[12〜84] 34.5[6〜60] 36.0[18〜46] 36.0[6〜84] 自立歩行月齢(月) 平均値±標準偏差 15.2±4.97 16.7±2.66 23.0±7.81 18.2±6.07 中央値[範囲] 13.0[12〜24] 18.0[12〜19] 20.0[16〜36] 18.0[12〜36] スクリーニング前
30日以内の徴候
及び症状
n(%)筋力低下 5(100.0) 5(83.3) 5(100.0) 15(93.8) つま先歩行 2(40.0) 1(16.7) 2(40.0) 5(31.3) 頻繁な転倒 1(20.0) 0 1(20.0) 2(12.5) 登り困難 3(60.0) 4(66.7) 4(80.0) 11(68.8) 床からの立ち上がり困難 3(60.0) 5(83.3) 4(80.0) 12(75.0) 階段の昇り困難 3(60.0) 5(83.3) 4(80.0) 12(75.0) 筋緊張低下 0 3(50.0) 1(20.0) 4(25.0) ふくらはぎの肥大 5(100.0) 6(100.0) 5(100.0) 16(100.0) 筋痙攣 1(20.0) 1(16.7) 0 2(12.5) 認知遅延 0 1(16.7) 2(40.0) 3(18.8) 言語発達遅延 0 2(33.3) 4(80.0) 6(37.5) 発育遅滞 1(20.0) 3(50.0) 5(100.0) 9(56.3) その他 1(20.0) 1(16.7) 2(40.0) 4(25.0) -
主要評価項目
ジストロフィンの発現(ウェスタンブロット法)
測定方法正常検体のジストロフィンの発現量を基準として、被験者のジストロフィンの相対発現量(%)を測定した。
リファレンスタンパク質にはミオシン重鎖とα-アクチニンを用いた。- ジストロフィンの発現は、いずれのリファレンスタンパク質で標準化した場合も、40 mg/kg群、80 mg/kg群及び全例のいずれにおいてもベースラインと比較して25週時で統計学的に有意に増加した(ミオシン重鎖:p=0.0004、p=0.0123、p<0.0001、α-アクチニン:p=0.0012、p=0.0074、p<0.0001、対応のあるt検定)。
- 群間比較では、ベースラインからのジストロフィンの発現の変化量に差は認められなかった(ミオシン重鎖:p=0.9384、α-アクチニン:p=0.1658、対応のないt検定)。
ジストロフィンの発現量

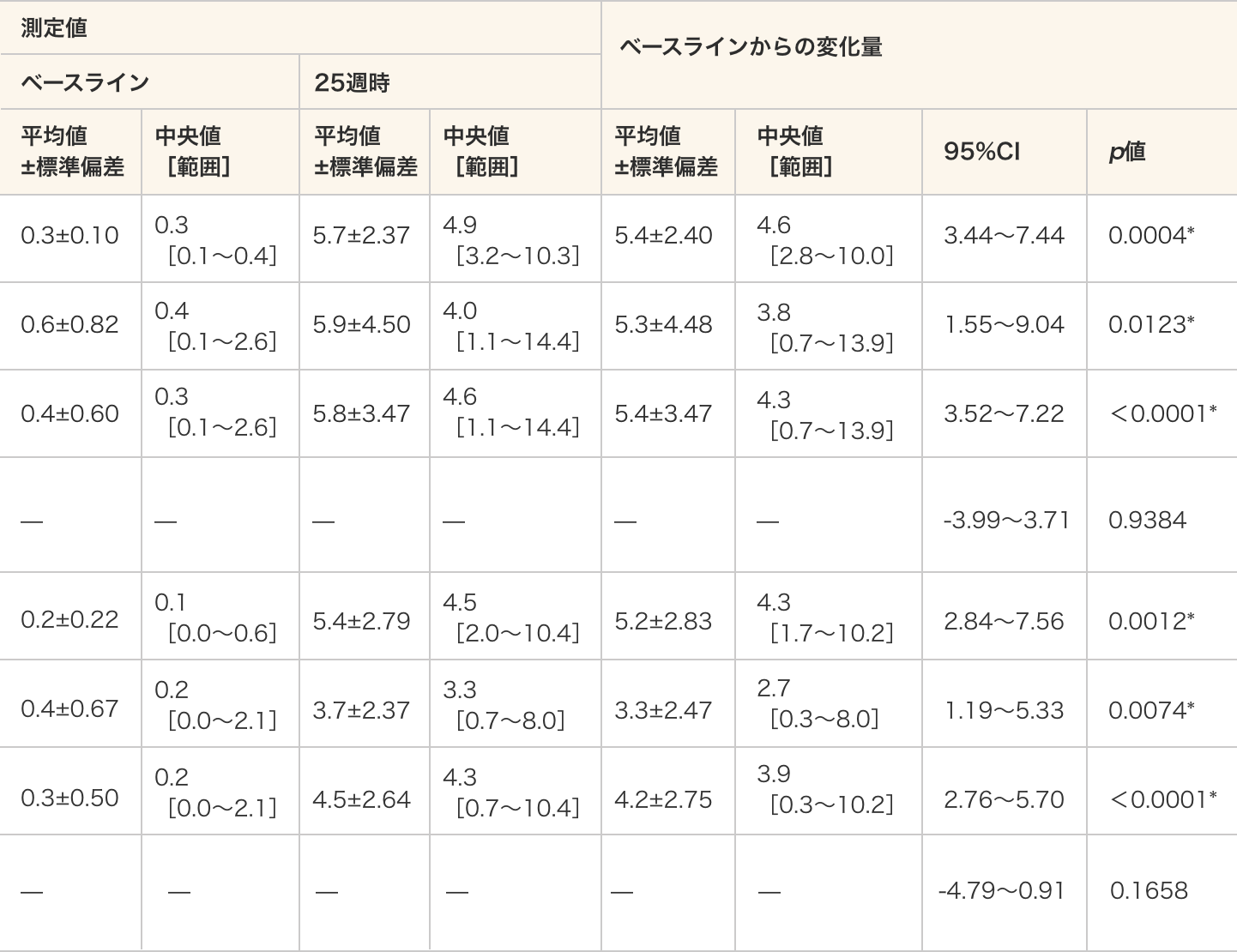

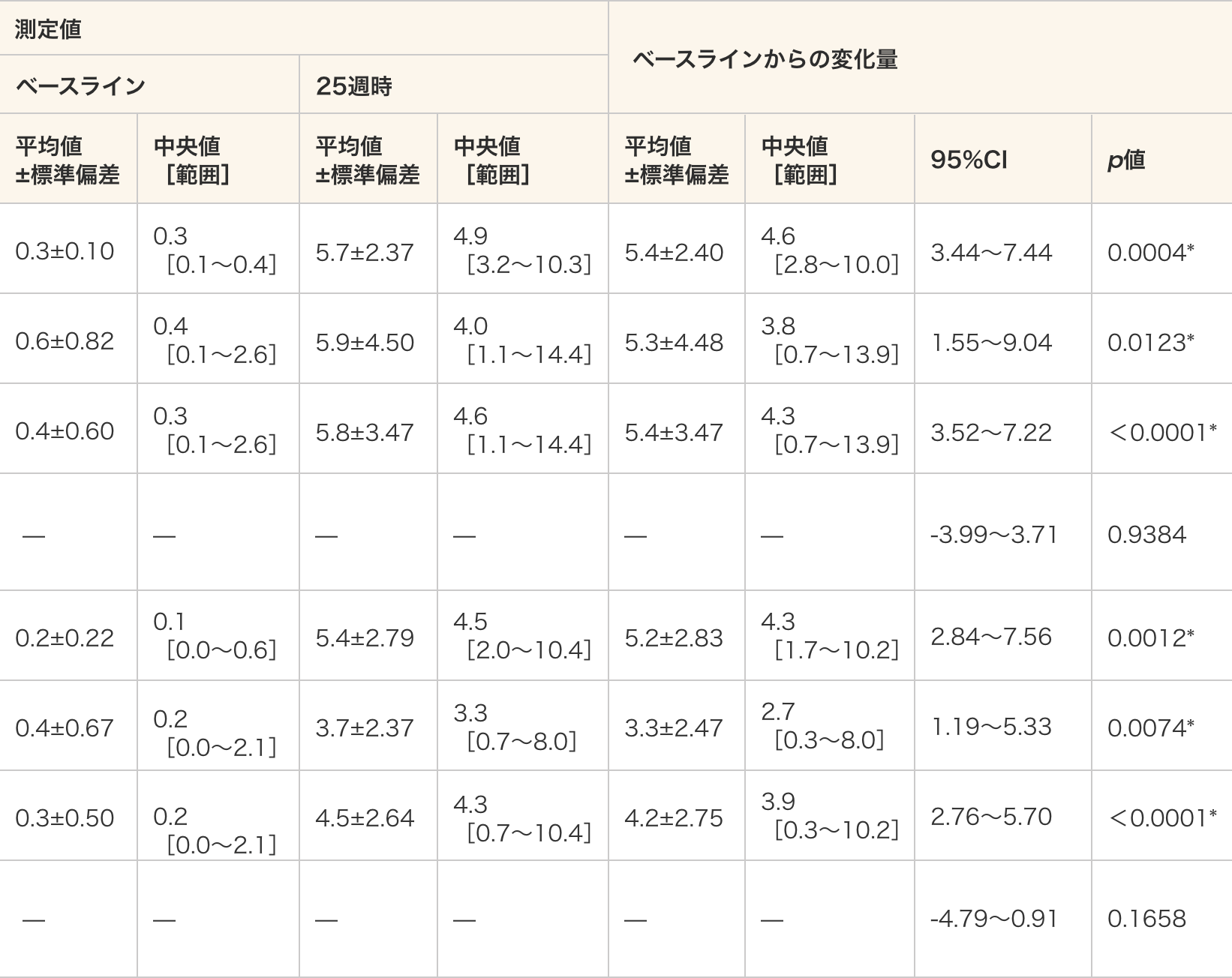
- 単位:%
- *:p≦0.05(各投与群:対応のある t 検定、群間比較:対応のないt検定)
-
副次評価項目
(1)ジストロフィンの発現とエクソン53スキッピング効率
1)ジストロフィンの発現(免疫蛍光染色)
ジストロフィン陽性筋線維数の割合の算出方法ジストロフィンとラミニンα2の同時染色により染色された筋線維を計測し、ジストロフィン陽性筋線維数の割合(%)を評価した。
- ジストロフィン陽性筋線維数の割合は40 mg/kg群、80 mg/kg群及び全例のいずれにおいてもベースラインと比較して25週時で統計学的に有意に増加した(p=0.0028、p=0.0026、p=0.0002、対応のあるt検定)。
- 群間比較では、ベースラインからのジストロフィンの発現の変化量に統計学的な有意差が認められた(p=0.0282、対応のないt検定)。
ジストロフィン陽性筋線維数の割合

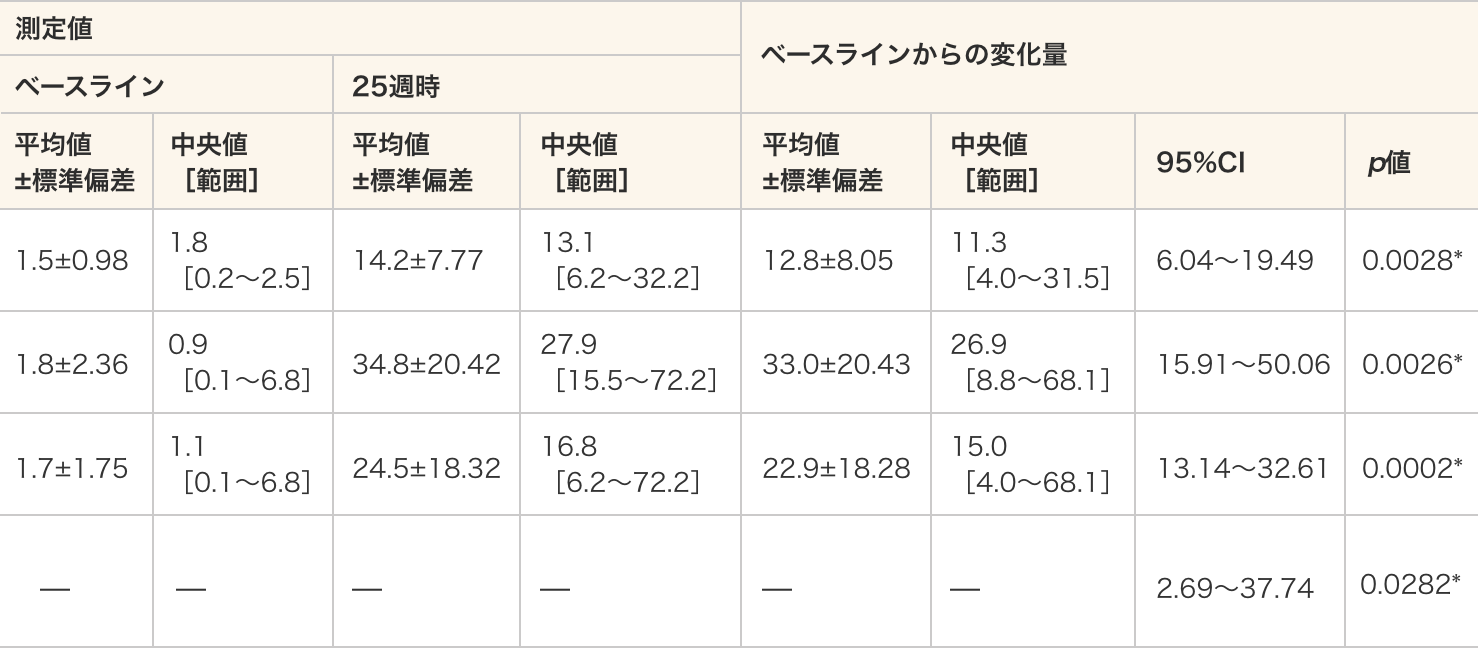
測定値 ベースラインからの変化量 ベースライン 25週時 平均値
±標準偏差中央値
[範囲]平均値
±標準偏差中央値
[範囲]平均値
±標準偏差中央値
[範囲]95%CI p値 40 mg/kg
(n=8)1.5±0.98 1.8
[0.2〜2.5]14.2±7.77 13.1
[6.2〜32.2]12.8±8.05 11.3
[4.0〜31.5]6.04〜19.49 0.0028* 80 mg/kg
(n=8)1.8±2.36 0.9
[0.1〜6.8]34.8±20.42 27.9
[15.5〜72.2]33.0±20.43 26.9
[8.8〜68.1]15.91〜50.06 0.0026* 全例
(n=16)1.7±1.75 1.1
[0.1〜6.8]24.5±18.32 16.8
[6.2〜72.2]22.9±18.28 15.0
[4.0〜68.1]13.14〜32.61 0.0002* 群間比較
(80 mg/kg
−40 mg/kg)— — — — — — 2.69〜37.74 0.0282* - 単位:%
結果はベッカー型筋ジストロフィー患者1名のジストロフィン陽性筋線維をおよそ80%と設定した際の数値を示す。正常対照はおよそ100%を示す。 - *:p≦0.05(各投与群:対応のある t 検定、群間比較:対応のないt検定)
2)ジストロフィンの発現(質量分析)
測定方法13C、15Nで標識したアミノ酸を含む培地で筋管細胞の培養を行い、stable isotope labelling by amino acids in cell culture(SILAC)を作製し、SILAC由来及び臨床検体由来のジストロフィンペプチド断片をLC-MS/MSにより測定し、フィラミンCで標準化してジストロフィンの発現量(%)を算出した。
- ジストロフィンの発現は40 mg/kg群、80 mg/kg群及び全例のいずれにおいてもベースラインと比較して25週時で統計学的に有意に増加した(p=0.0061、p=0.0300、p=0.0030、対応のあるt検定)。
- 群間比較では、ベースラインからのジストロフィンの発現の変化量に差は認められなかった(p=0.1649、対応のないt検定)。
ジストロフィンの発現量

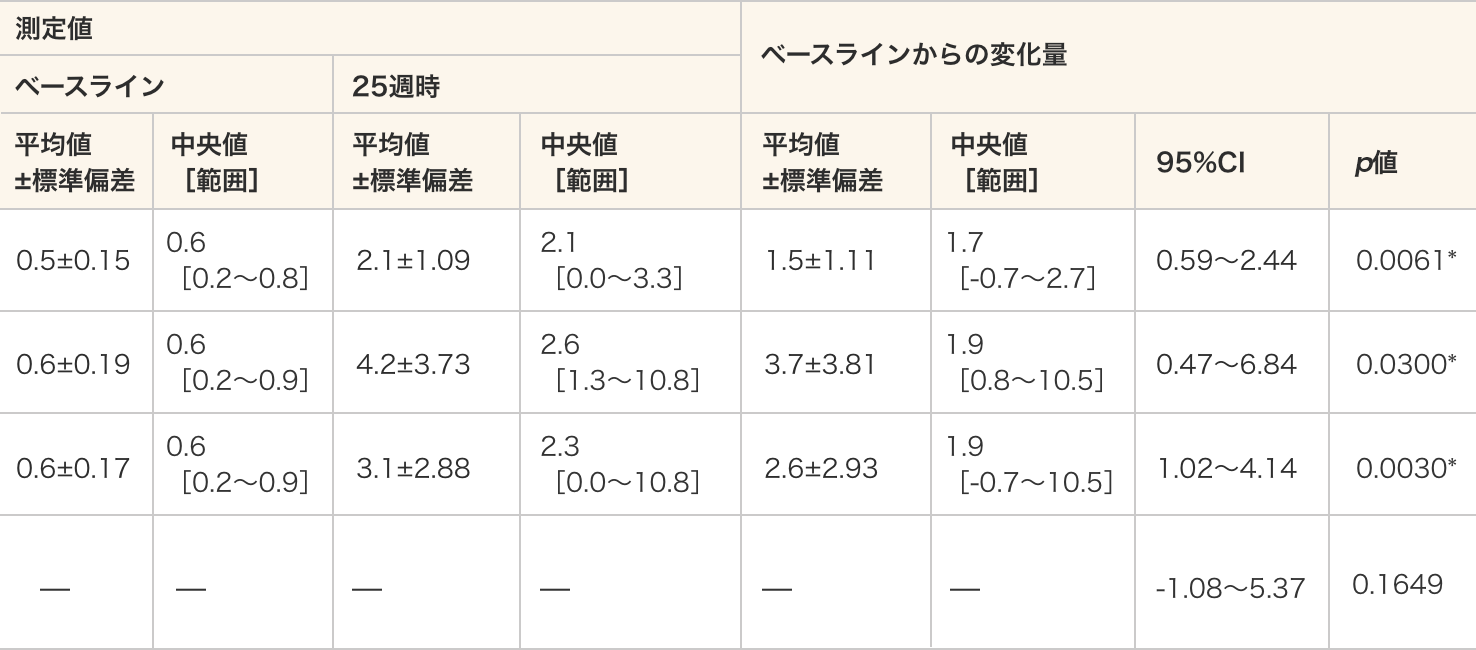
測定値 ベースラインからの変化量 ベースライン 25週時 平均値
±標準偏差中央値
[範囲]平均値
±標準偏差中央値
[範囲]平均値
±標準偏差中央値
[範囲]95%CI p値 40 mg/kg
(n=8)0.5±0.15 0.6
[0.2〜0.8]2.1±1.09 2.1
[0.0〜3.3]1.5±1.11 1.7
[-0.7〜2.7]0.59〜2.44 0.0061* 80 mg/kg
(n=8)0.6±0.19 0.6
[0.2〜0.9]4.2±3.73 2.6
[1.3〜10.8]3.7±3.81 1.9
[0.8〜10.5]0.47〜6.84 0.0300* 全例
(n=16)0.6±0.17 0.6
[0.2〜0.9]3.1±2.88 2.3
[0.0〜10.8]2.6±2.93 1.9
[-0.7〜10.5]1.02〜4.14 0.0030* 群間比較
(80 mg/kg
−40 mg/kg)— — — — — — -1.08〜5.37 0.1649 - 単位:%
- *:p≦0.05(各投与群:対応のある t 検定、群間比較:対応のないt検定)
3)エクソン53スキッピング効率(RT-PCR)
エクソン53スキッピング効率の算出方法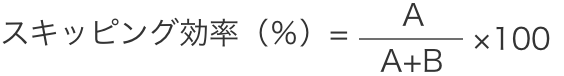 A:エクソン53を含まないPCR産物の定量値(モル濃度)
A:エクソン53を含まないPCR産物の定量値(モル濃度)
B:エクソン53を含むPCR産物の定量値(モル濃度)- ベースラインでは、全ての被験者がエクソン53スキッピング陰性であり、25週時では、全ての被験者においてエクソン53スキッピング陽性であった。
- エクソン53スキッピング効率は、40 mg/kg群、80 mg/kg群及び全例のいずれにおいてもベースラインと比較して25週時で統計学的に有意に増加した(p=0.0002、p=0.0001、p<0.0001、対応のあるt検定)。
- 群間比較では、ベースラインからのエクソン53スキッピング効率の変化量に統計学的な有意差が認められた(p=0.0023、対応のないt検定)。
エクソン53スキッピング効率

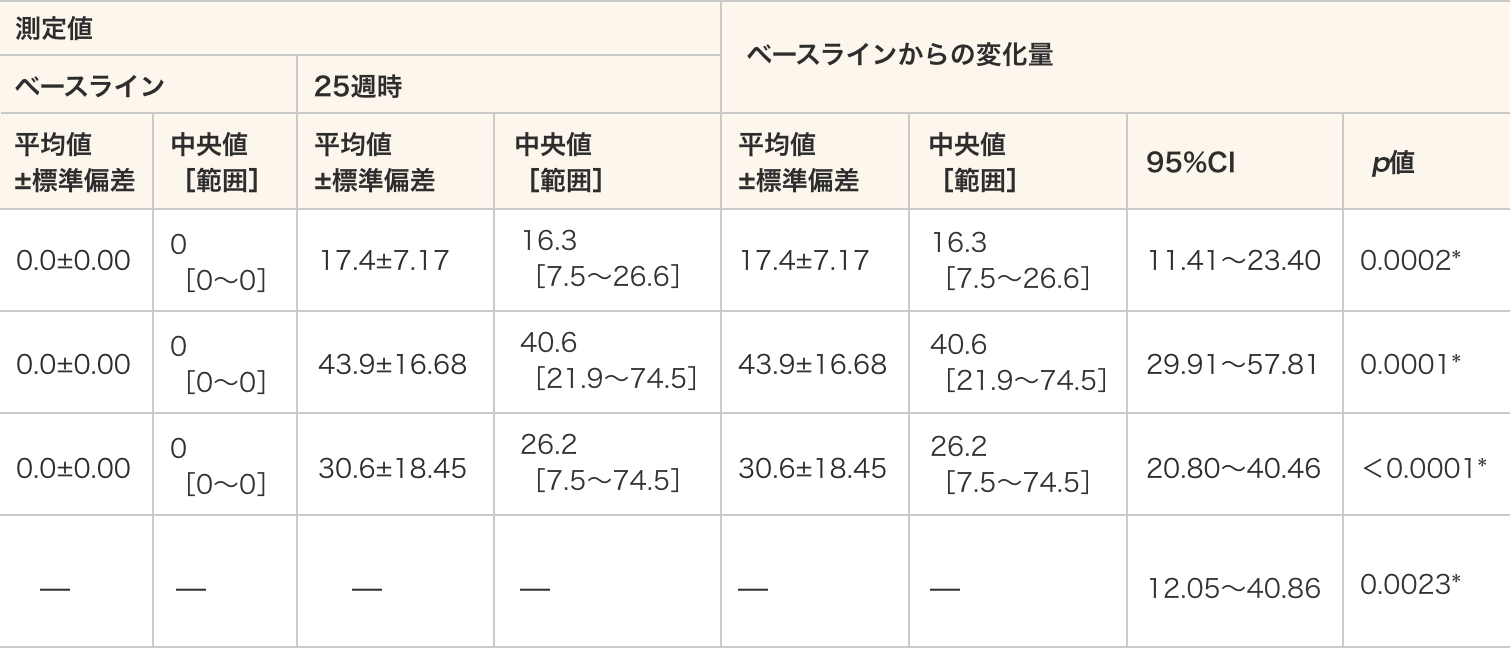
測定値 ベースラインからの変化量 ベースライン 25週時 平均値
±標準偏差中央値
[範囲]平均値
±標準偏差中央値
[範囲]平均値
±標準偏差中央値
[範囲]95%CI p値 40 mg/kg
(n=8)0.0±0.00 0
[0〜0]17.4±7.17 16.3
[7.5〜26.6]17.4±7.17 16.3
[7.5〜26.6]11.41〜23.40 0.0002* 80 mg/kg
(n=8)0.0±0.00 0
[0〜0]43.9±16.68 40.6
[21.9〜74.5]43.9±16.68 40.6
[21.9〜74.5]29.91〜57.81 0.0001* 全例
(n=16)0.0±0.00 0
[0〜0]30.6±18.45 26.2
[7.5〜74.5]30.6±18.45 26.2
[7.5〜74.5]20.80〜40.46 <0.0001* 群間比較
(80 mg/kg
−40 mg/kg)— — — — — — 12.05〜40.86 0.0023* - 単位:%
- *:p≦0.05(各投与群:対応のある t 検定、群間比較:対応のないt検定)
(2)運動機能評価
1)時間機能検査
- ビルトラルセン群(16例)について、時間機能検査[10 m歩行/走行時間(速度及び秒)、床からの立ち上がり時間(秒)、6分間歩行距離]の25週時のベースラインからの変化を自然歴群(DNHS)と比較したところ、有意な差が認められた(p=0.0029、p=0.0462、p=0.0366、p=0.0471、MMRM)。
25週時における時間機能検査のベースラインからの変化
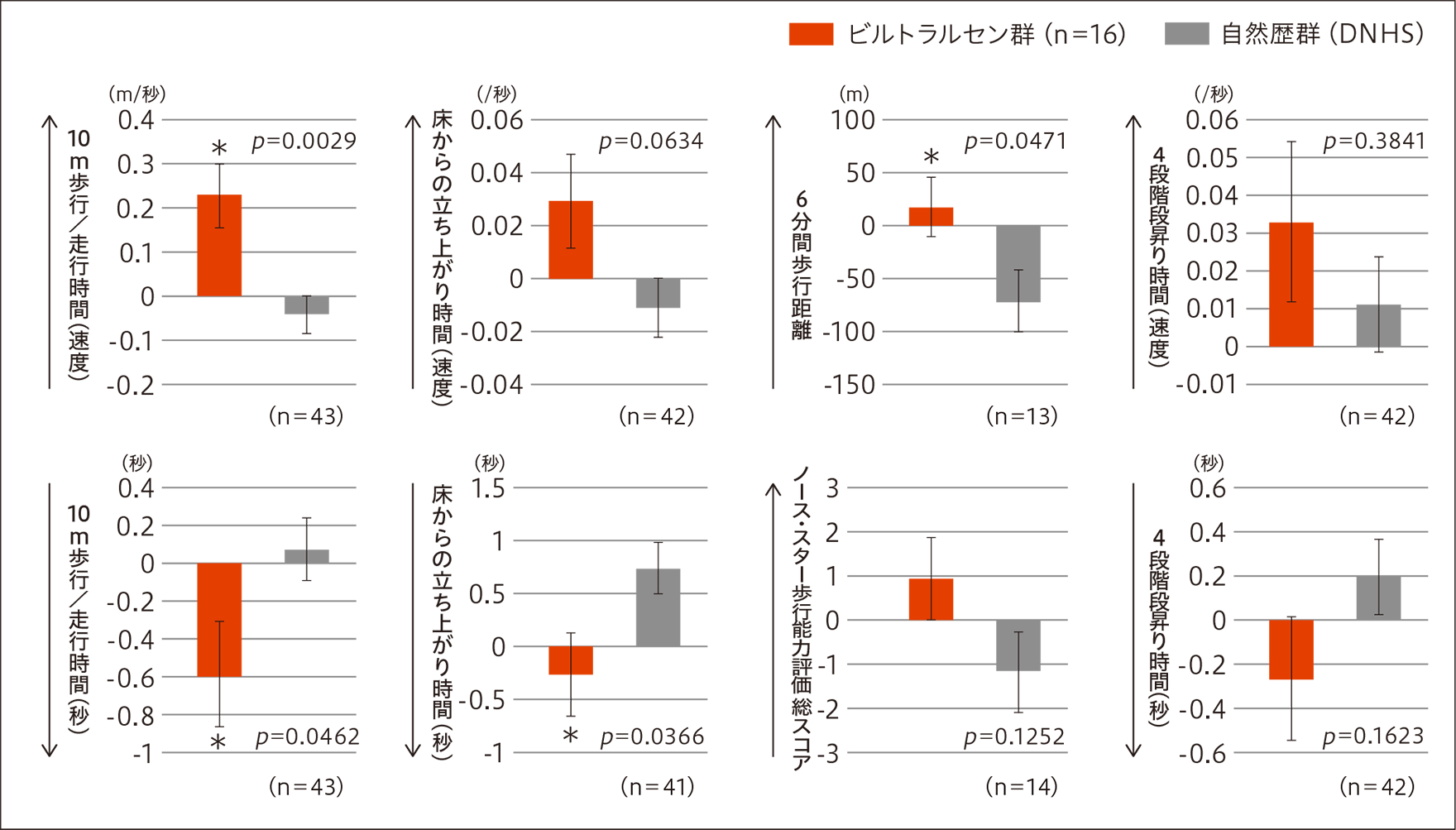
- ベースラインから25週時までの変化量のLSM±標準誤差。
- グラフの↑↓は、改善方向を示す。
- * p≦0.05(反復測定混合モデル解析:MMRM)
10 m歩行/走行時間(速度及び秒)
- 10 m歩行/走行時間(速度)は、80 mg/kg群及び全例においてベースラインと比較して25週時で統計学的な有意差が認められた(p=0.0177、p=0.0025、対応のあるt検定)。
- 10 m歩行/走行時間(速度)は、ビルトラルセンのいずれの用量群においても自然歴群(DNHS)と比較して統計学的な有意差が認められた(p=0.0365、p=0.0132、p=0.0029、MMRM)。
- 10 m歩行/走行時間(秒)は、全例においてベースラインと比較して25週時で統計学的な有意差が認められた(p=0.0241、対応のあるt検定)。
- 10 m歩行/走行時間(秒)は、ビルトラルセン群の全例において自然歴群(DNHS)と比較して統計学的な有意差が認められた(p=0.0462、MMRM)。

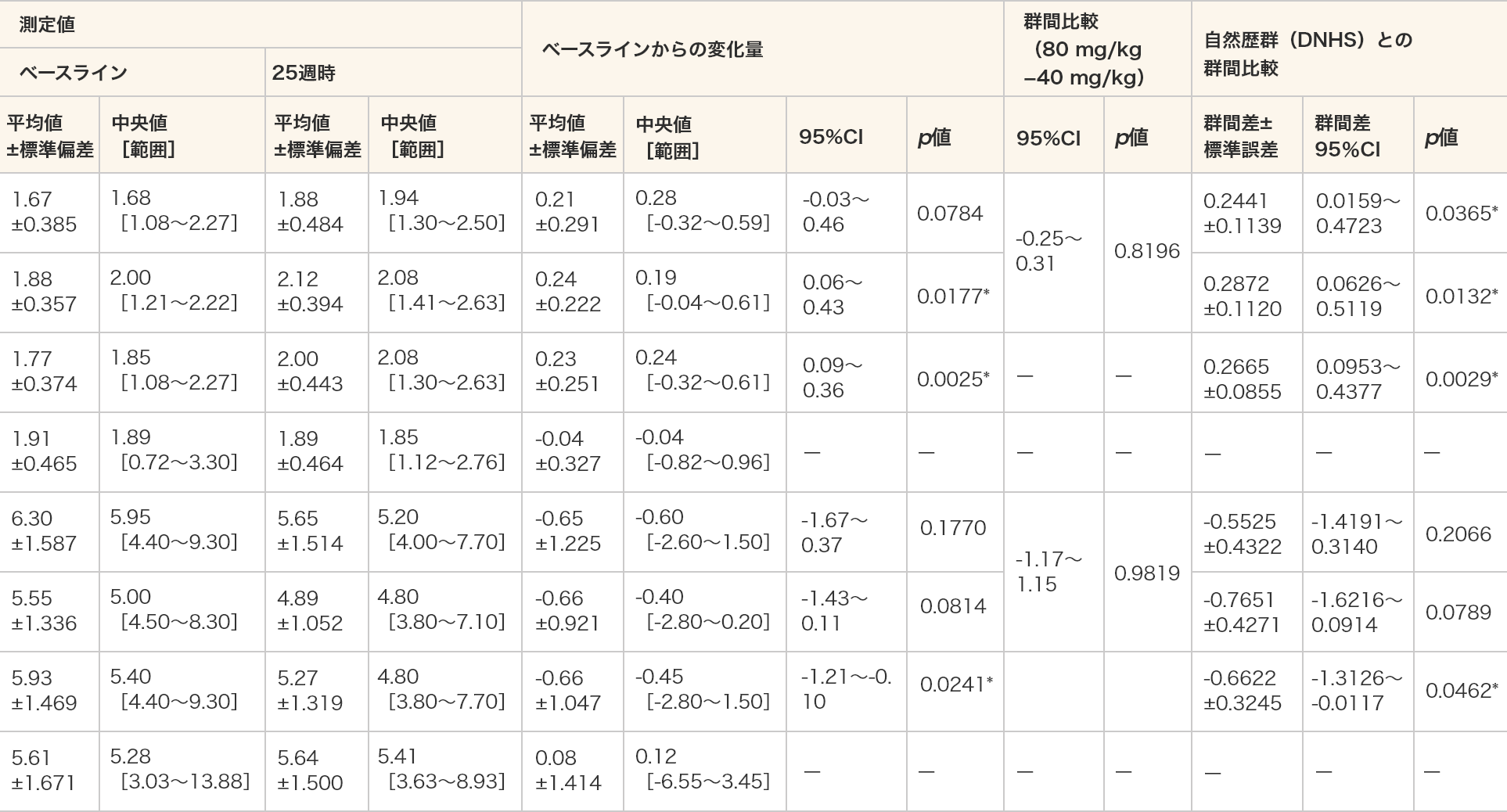

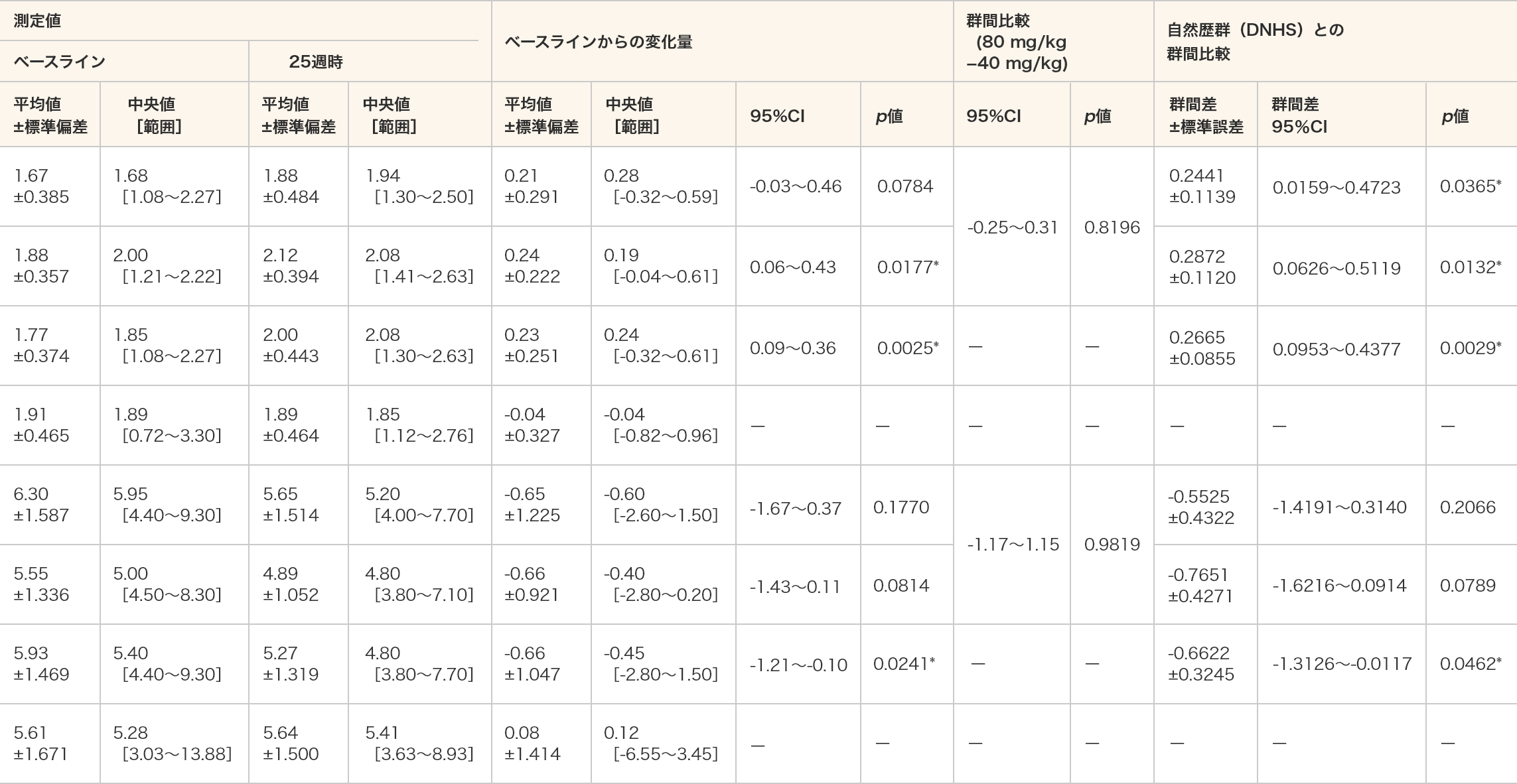
- 単位(速度):m/秒
- *:p≦0.05(各投与群:対応のある t 検定、群間比較:対応のないt検定、DNHSとの群間比較:MMRM)
床からの立ち上がり時間(速度及び秒)
- 床からの立ち上がり時間(秒)は、ビルトラルセン群の全例において自然歴群(DNHS)と比較して統計学的な有意差が認められた(p=0.0366、MMRM)。
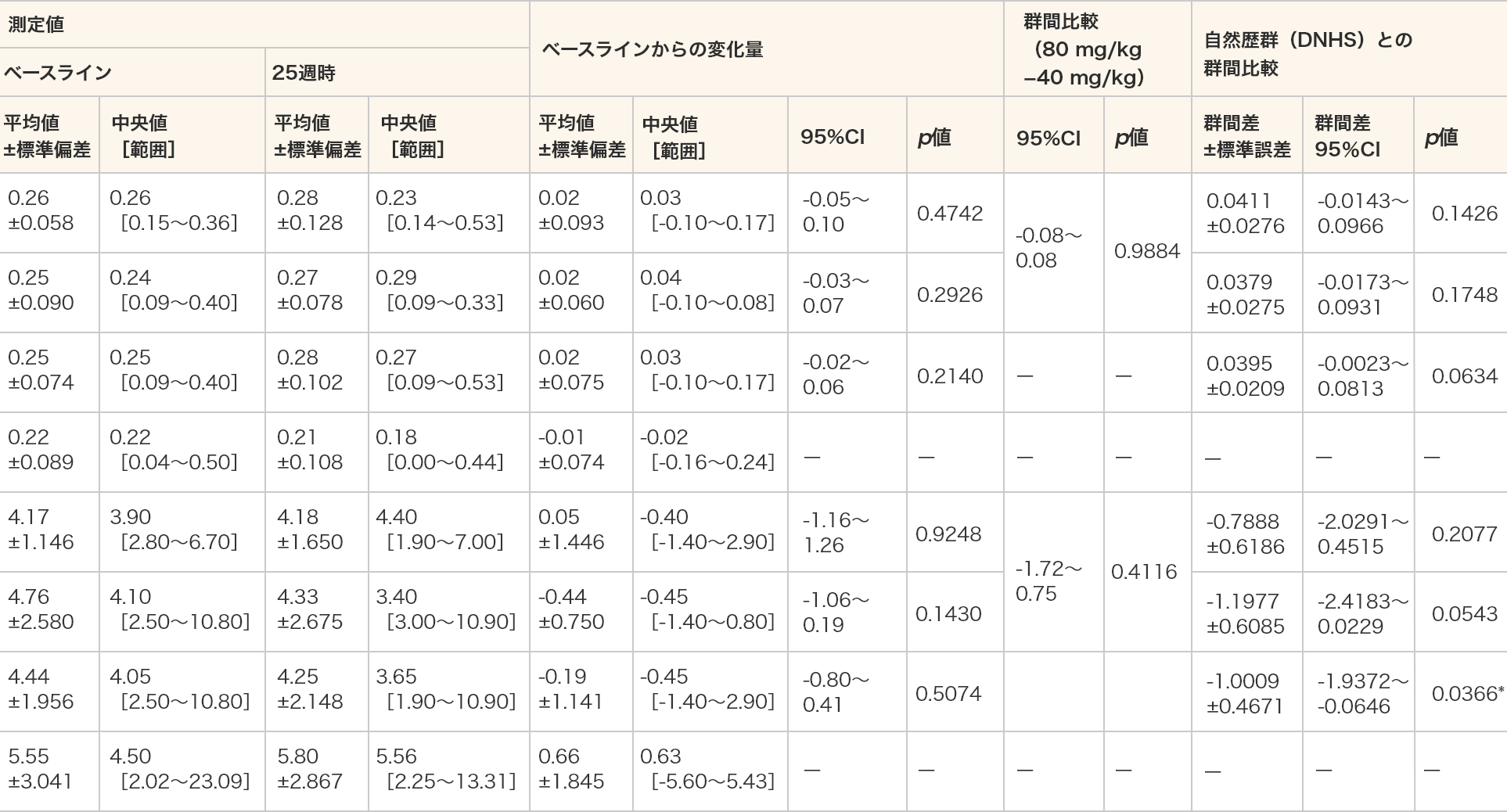

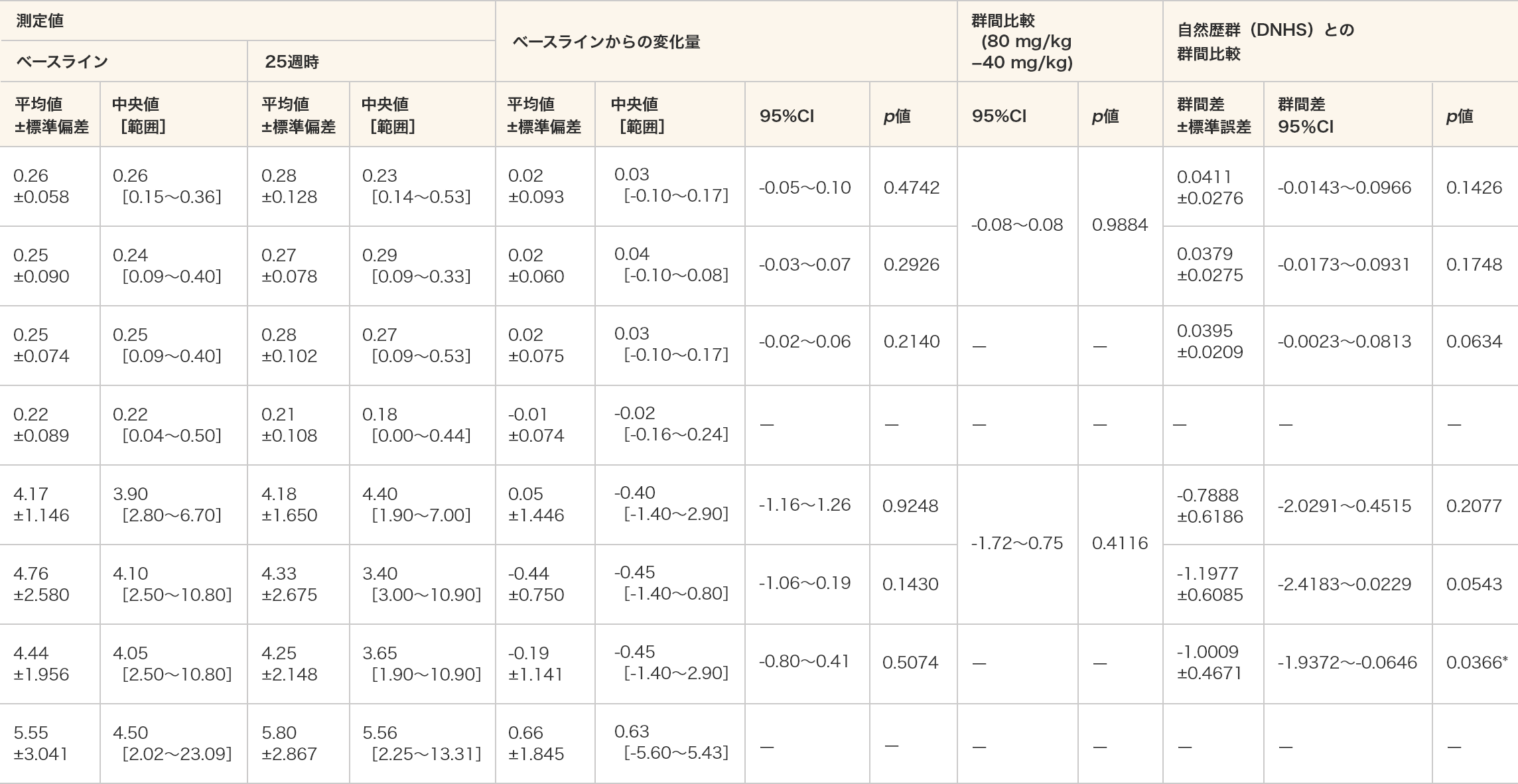
- 単位(速度):/秒(床からの立ち上がり時間(秒)の逆数とした。)
- *:p≦0.05(各投与群:対応のある t 検定、群間比較:対応のないt検定、DNHSとの群間比較:MMRM)
6分間歩行距離
- 6分間歩行距離(m)は、80 mg/kg群及び全例においてベースラインと比較して25週時で統計学的な有意差が認められた(p=0.0323、p=0.0082、対応のあるt検定)。
- 自然歴群(DNHS)との比較では、ビルトラルセン群の全例において統計学的な有意差が認められた(p=0.0471、MMRM)。

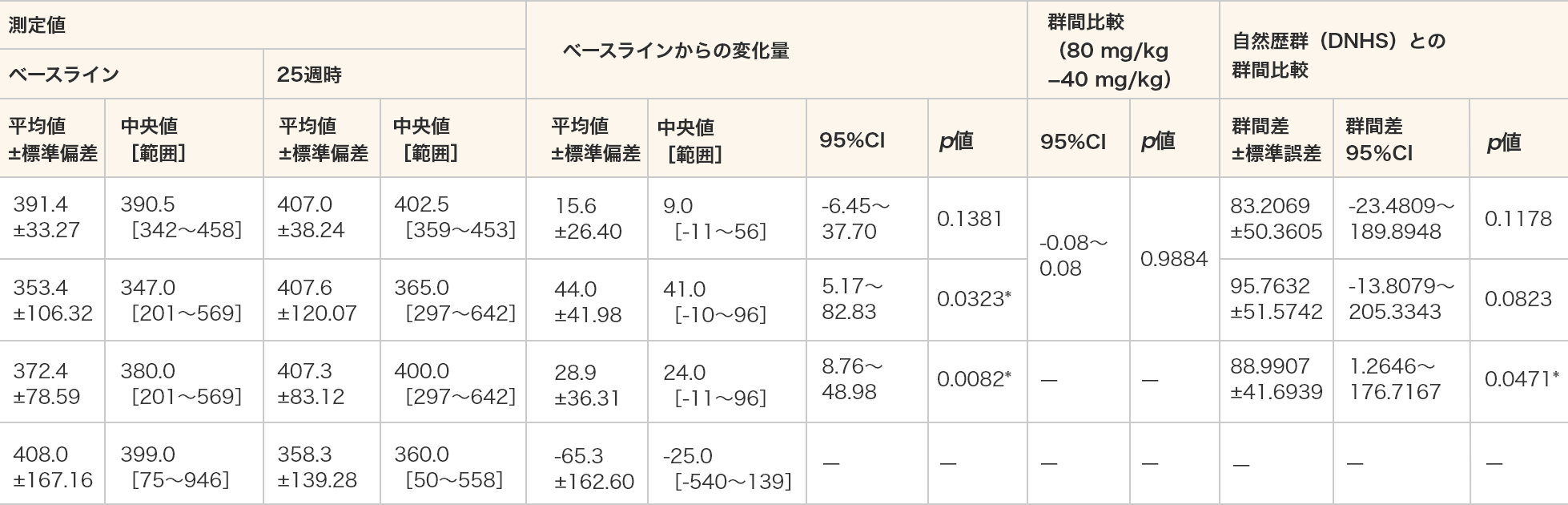

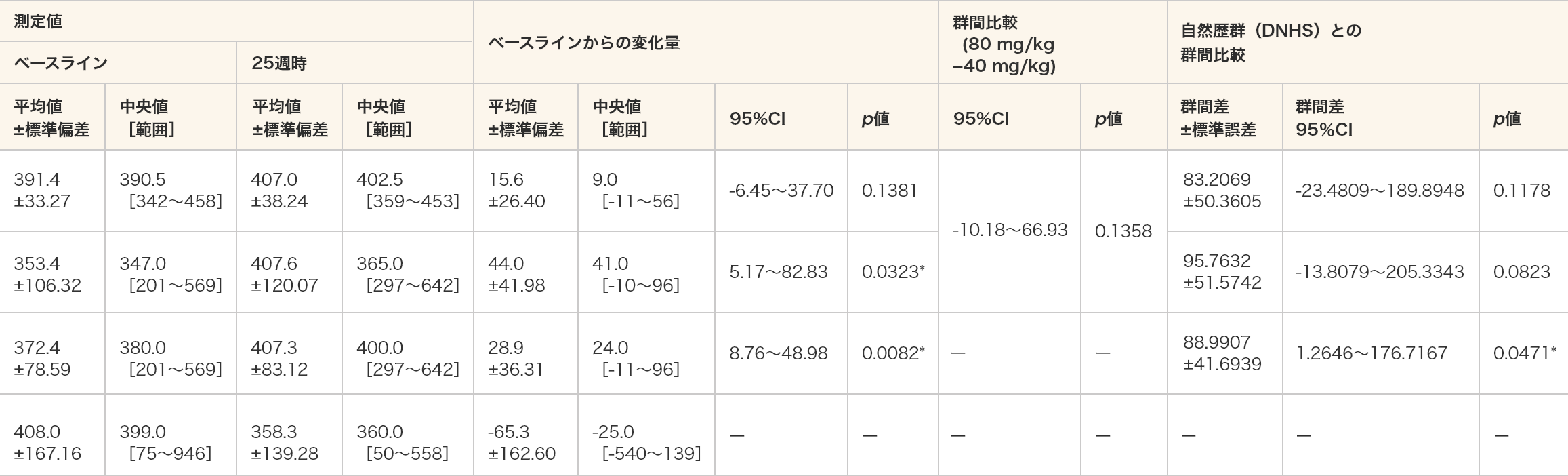
- 単位:m
- *:p≦0.05(各投与群:対応のある t 検定、群間比較:対応のないt検定、DNHSとの群間比較:MMRM)
4段階段昇り時間(速度及び秒)
- 4段階段昇り時間(速度及び秒)はいずれの群においてもベースラインと比較して25週時で統計学的に有意な差は認められなかった。

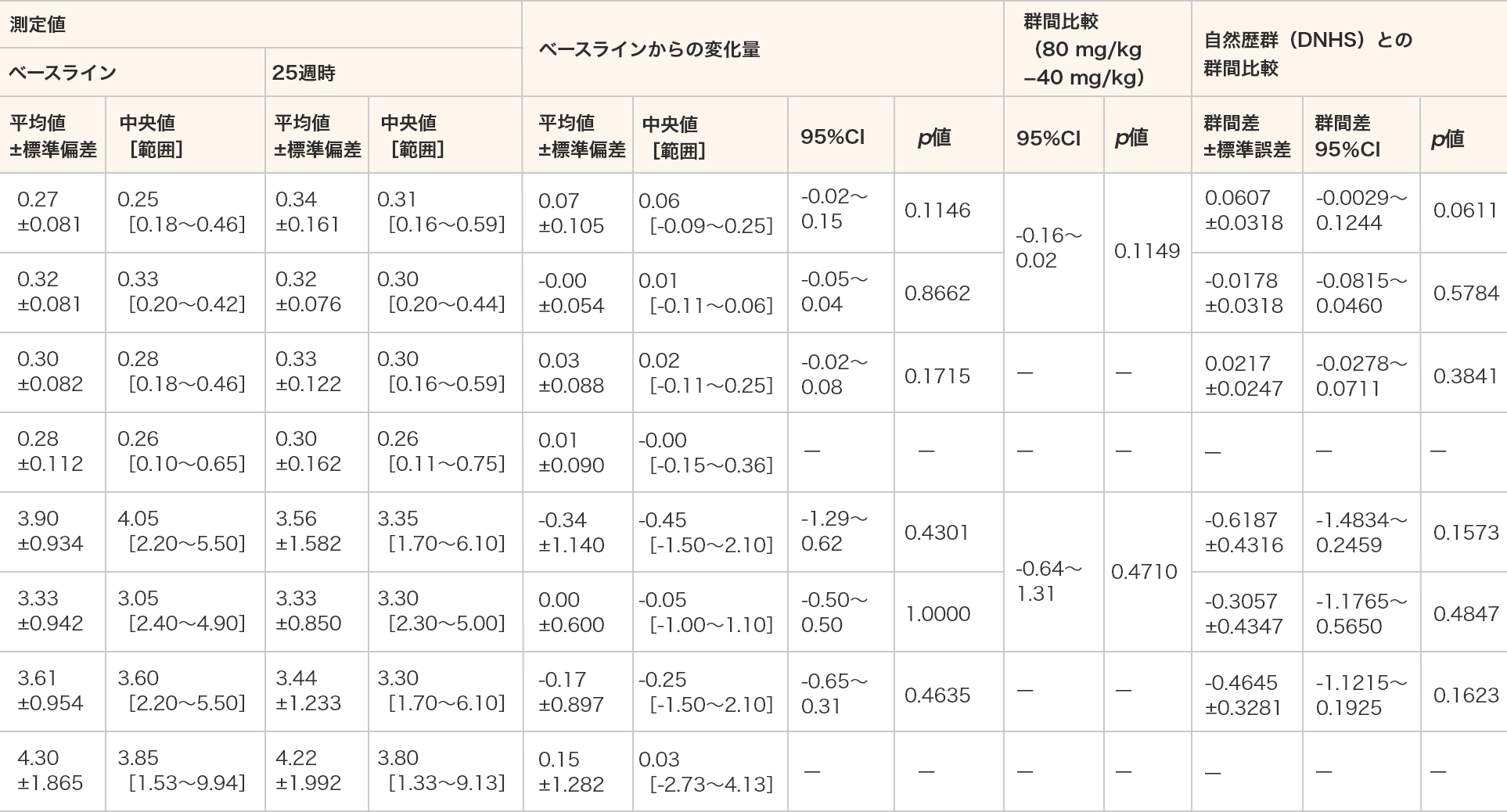

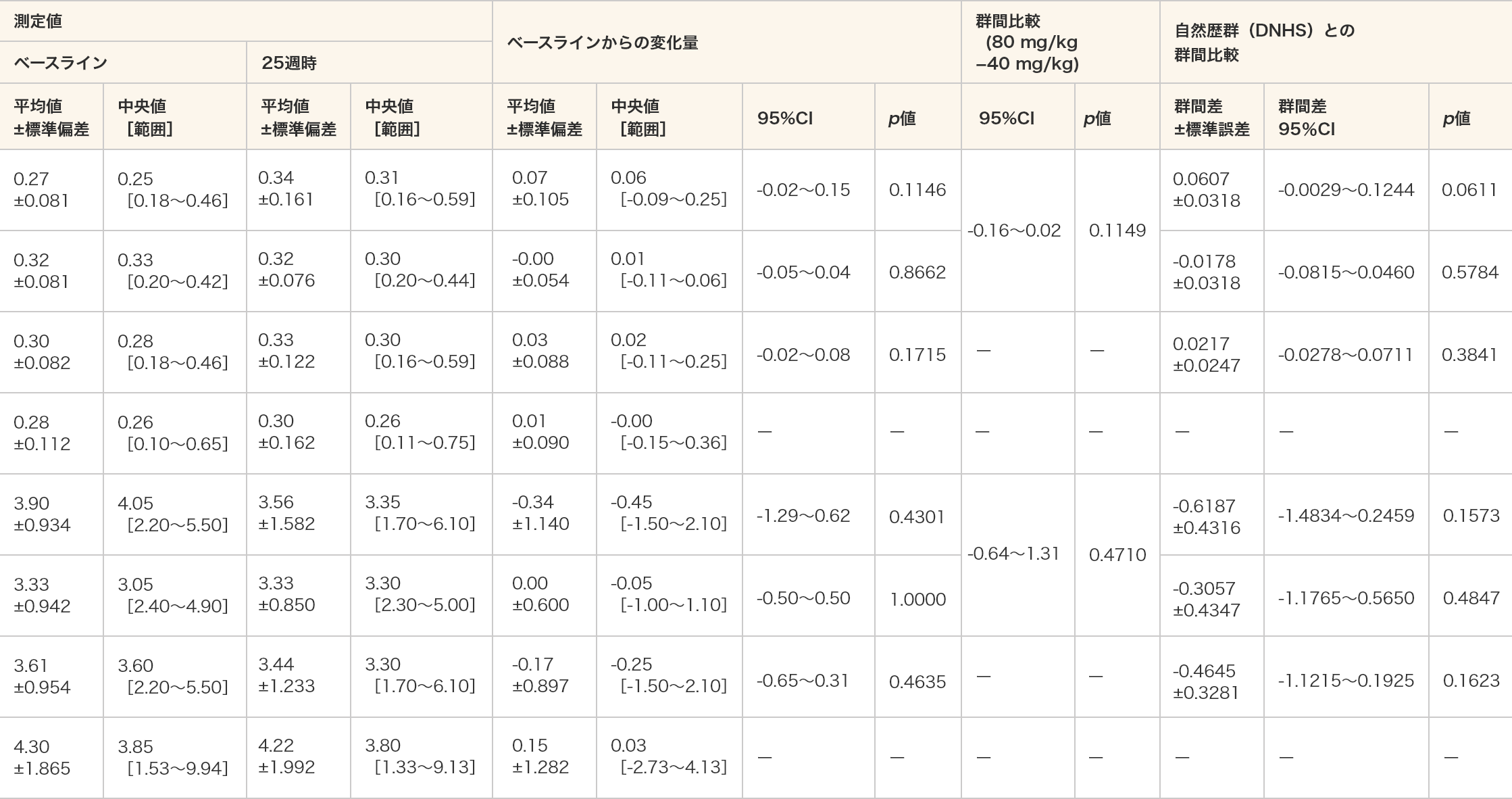
- 単位(速度):/秒(4段階段昇り時間(秒)の逆数とした。)
- 各投与群:対応のある t 検定、群間比較:対応のないt検定、DNHSとの群間比較:MMRM
ノース・スター歩行能力評価
- ノース・スター歩行能力評価総スコアはいずれの群においてもベースラインと比較して25週時で統計学的に有意な差は認められなかった。

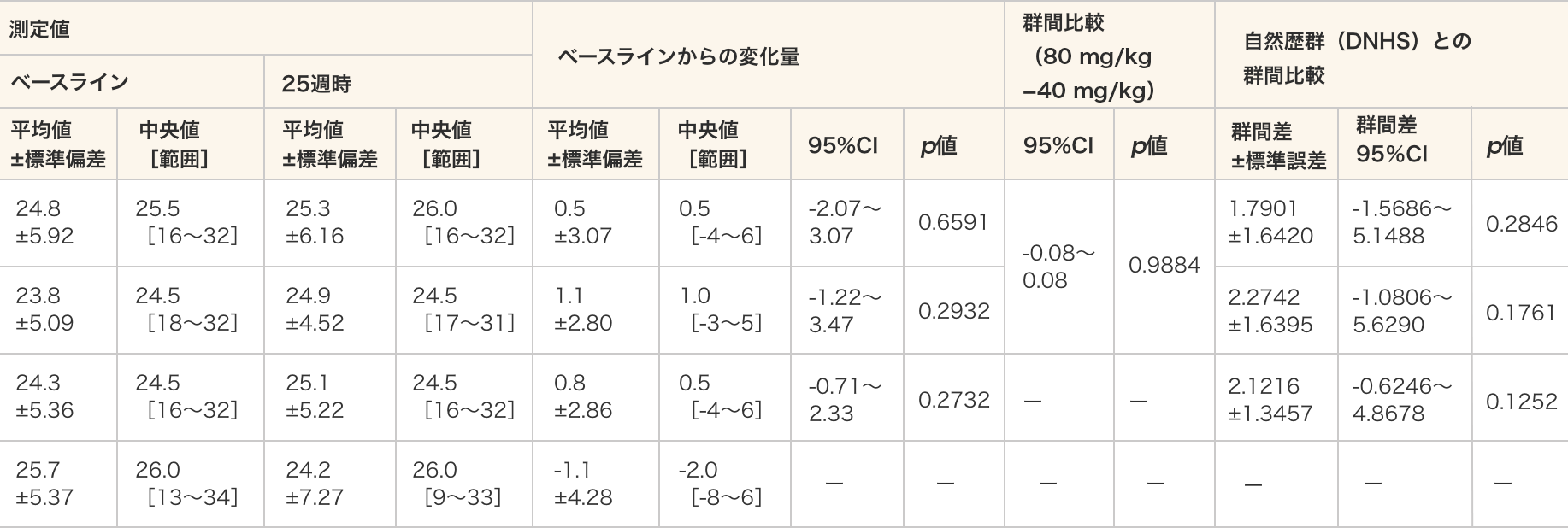

- 各投与群:対応のある t 検定、群間比較:対応のないt検定、DNHSとの群間比較:MMRM
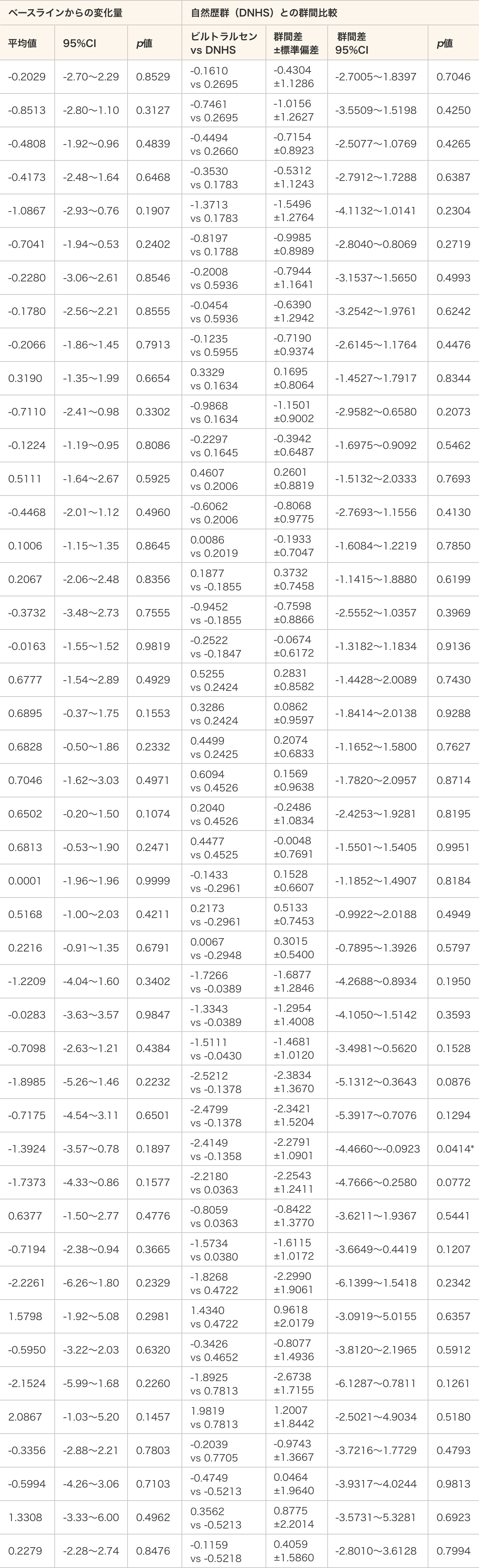
2)定量的筋力検査
- ビルトラルセン群及び自然歴群(DNHS)のいずれも、ベースラインから25週時までの変化量は統計学的に有意ではなかった。
- ビルトラルセン群と自然歴群(DNHS)を比較した結果、利足側膝関節屈曲においてビルトラルセンの投与群全例で統計学的な有意差が認められた(p=0.0414、MMRM)。
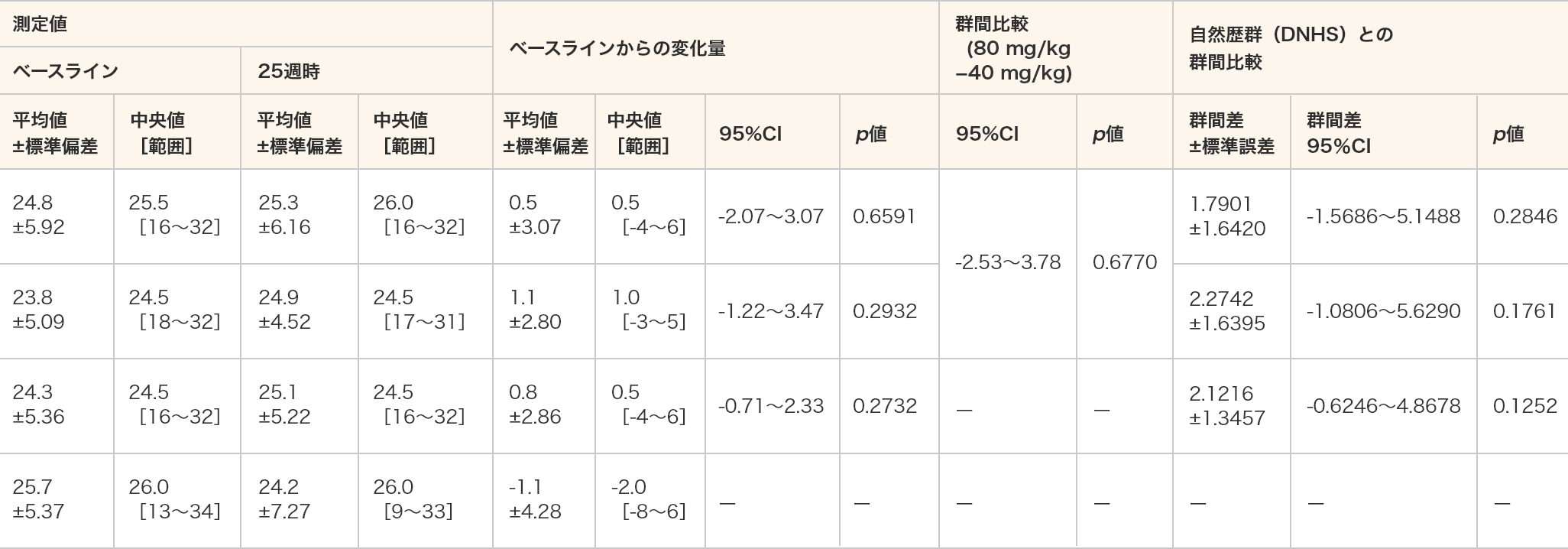
定量的筋力検査

ベースラインからの変化量 自然歴群(DNHS)との群間比較 平均値 95%CI p値 ビルトラルセン
vs DNHS群間差
±標準偏差群間差
95%CIp値 握力 40 mg/kg -0.2029 -2.70〜2.29 0.8529 -0.1610
vs 0.2695-0.4304
±1.1286-2.7005〜1.8397 0.7046 80 mg/kg -0.8513 -2.80〜1.10 0.3127 -0.7461
vs 0.2695-1.0156
±1.2627-3.5509〜1.5198 0.4250 全例 -0.4808 -1.92〜0.96 0.4839 -0.4494
vs 0.2660-0.7154
±0.8923-2.5077〜1.0769 0.4265 利手側
握力40 mg/kg -0.4173 -2.48〜1.64 0.6468 -0.3530
vs 0.1783-0.5312
±1.1243-2.7912〜1.7288 0.6387 80 mg/kg -1.0867 -2.93〜0.76 0.1907 -1.3713
vs 0.1783-1.5496
±1.2764-4.1132〜1.0141 0.2304 全例 -0.7041 -1.94〜0.53 0.2402 -0.8197
vs 0.1788-0.9985
±0.8989-2.8040〜0.8069 0.2719 非利手側
握力40 mg/kg -0.2280 -3.06〜2.61 0.8546 -0.2008
vs 0.5936-0.7944
±1.1641-3.1537〜1.5650 0.4993 80 mg/kg -0.1780 -2.56〜2.21 0.8555 -0.0454
vs 0.5936-0.6390
±1.2942-3.2542〜1.9761 0.6242 全例 -0.2066 -1.86〜1.45 0.7913 -0.1235
vs 0.5955-0.7190
±0.9374-2.6145〜1.1764 0.4476 肘関節
屈曲40 mg/kg 0.3190 -1.35〜1.99 0.6654 0.3329
vs 0.16340.1695
±0.8064-1.4527〜1.7917 0.8344 80 mg/kg -0.7110 -2.41〜0.98 0.3302 -0.9868
vs 0.1634-1.1501
±0.9002-2.9582〜0.6580 0.2073 全例 -0.1224 -1.19〜0.95 0.8086 -0.2297
vs 0.1645-0.3942
±0.6487-1.6975〜0.9092 0.5462 利手側
肘関節
屈曲40 mg/kg 0.5111 -1.64〜2.67 0.5925 0.4607
vs 0.20060.2601
±0.8819-1.5132〜2.0333 0.7693 80 mg/kg -0.4468 -2.01〜1.12 0.4960 -0.6062
vs 0.2006-0.8068
±0.9775-2.7693〜1.1556 0.4130 全例 0.1006 -1.15〜1.35 0.8645 0.0086
vs 0.2019-0.1933
±0.7047-1.6084〜1.2219 0.7850 非利手側
肘関節
屈曲40 mg/kg 0.2067 -2.06〜2.48 0.8356 0.1877
vs -0.18550.3732
±0.7458-1.1415〜1.8880 0.6199 80 mg/kg -0.3732 -3.48〜2.73 0.7555 -0.9452
vs -0.1855-0.7598
±0.8866-2.5552〜1.0357 0.3969 全例 -0.0163 -1.55〜1.52 0.9819 -0.2522
vs -0.1847-0.0674
±0.6172-1.3182〜1.1834 0.9136 肘関節
伸展40 mg/kg 0.6777 -1.54〜2.89 0.4929 0.5255
vs 0.24240.2831
±0.8582-1.4428〜2.0089 0.7430 80 mg/kg 0.6895 -0.37〜1.75 0.1553 0.3286
vs 0.24240.0862
±0.9597-1.8414〜2.0138 0.9288 全例 0.6828 -0.50〜1.86 0.2332 0.4499
vs 0.24250.2074
±0.6833-1.1652〜1.5800 0.7627 利手側
肘関節
伸展40 mg/kg 0.7046 -1.62〜3.03 0.4971 0.6094
vs 0.45260.1569
±0.9638-1.7820〜2.0957 0.8714 80 mg/kg 0.6502 -0.20〜1.50 0.1074 0.2040
vs 0.4526-0.2486
±1.0834-2.4253〜1.9281 0.8195 全例 0.6813 -0.53〜1.90 0.2471 0.4477
vs 0.4525-0.0048
±0.7691-1.5501〜1.5405 0.9951 非利手側
肘関節
伸展40 mg/kg 0.0001 -1.96〜1.96 0.9999 -0.1433
vs -0.29610.1528
±0.6607-1.1852〜1.4907 0.8184 80 mg/kg 0.5168 -1.00〜2.03 0.4211 0.2173
vs -0.29610.5133
±0.7453-0.9922〜2.0188 0.4949 全例 0.2216 -0.91〜1.35 0.6791 0.0067
vs -0.29480.3015
±0.5400-0.7895〜1.3926 0.5797 膝関節
屈曲40 mg/kg -1.2209 -4.04〜1.60 0.3402 -1.7266
vs -0.0389-1.6877
±1.2846-4.2688〜0.8934 0.1950 80 mg/kg -0.0283 -3.63〜3.57 0.9847 -1.3343
vs -0.0389-1.2954
±1.4008-4.1050〜1.5142 0.3593 全例 -0.7098 -2.63〜1.21 0.4384 -1.5111
vs -0.0430-1.4681
±1.0120-3.4981〜0.5620 0.1528 利足側
膝関節
屈曲40 mg/kg -1.8985 -5.26〜1.46 0.2232 -2.5212
vs -0.1378-2.3834
±1.3670-5.1312〜0.3643 0.0876 80 mg/kg -0.7175 -4.54〜3.11 0.6501 -2.4799
vs -0.1378-2.3421
±1.5204-5.3917〜0.7076 0.1294 全例 -1.3924 -3.57〜0.78 0.1897 -2.4149
vs -0.1358-2.2791
±1.0901-4.4660〜-0.0923 0.0414* 非利足側
膝関節
屈曲40 mg/kg -1.7373 -4.33〜0.86 0.1577 -2.2180
vs 0.0363-2.2543
±1.2411-4.7666〜0.2580 0.0772 80 mg/kg 0.6377 -1.50〜2.77 0.4776 -0.8059
vs 0.0363-0.8422
±1.3770-3.6211〜1.9367 0.5441 全例 -0.7194 -2.38〜0.94 0.3665 -1.5734
vs 0.0380-1.6115
±1.0172-3.6649〜0.4419 0.1207 膝関節
伸筋40 mg/kg -2.2261 -6.26〜1.80 0.2329 -1.8268
vs 0.4722-2.2990
±1.9061-6.1399〜1.5418 0.2342 80 mg/kg 1.5798 -1.92〜5.08 0.2981 1.4340
vs 0.47220.9618
±2.0179-3.0919〜5.0155 0.6357 全例 -0.5950 -3.22〜2.03 0.6320 -0.3426
vs 0.4652-0.8077
±1.4936-3.8120〜2.1965 0.5912 利足側
膝関節
伸筋40 mg/kg -2.1524 -5.99〜1.68 0.2260 -1.8925
vs 0.7813-2.6738
±1.7155-6.1287〜0.7811 0.1261 80 mg/kg 2.0867 -1.03〜5.20 0.1457 1.9819
vs 0.78131.2007
±1.8442-2.5021〜4.9034 0.5180 全例 -0.3356 -2.88〜2.21 0.7803 -0.2039
vs 0.7705-0.9743
±1.3667-3.7216〜1.7729 0.4793 非利足側
膝関節
伸筋40 mg/kg -0.5994 -4.26〜3.06 0.7103 -0.4749
vs -0.52130.0464
±1.9640-3.9317〜4.0244 0.9813 80 mg/kg 1.3308 -3.33〜6.00 0.4962 0.3562
vs -0.52130.8775
±2.2014-3.5731〜5.3281 0.6923 全例 0.2279 -2.28〜2.74 0.8476 -0.1159
vs -0.52180.4059
±1.5860-2.8010〜3.6128 0.7994 - 単位:重量ポンド(1重量ポンド=4.4822N)
- グループBの40 mg/kg群(8例)、80 mg/kg群(6例)を対象とした。
- *:p≦0.05(各投与群:対応のあるt検定、DNHSとの群間比較:MMRM)
-
安全性
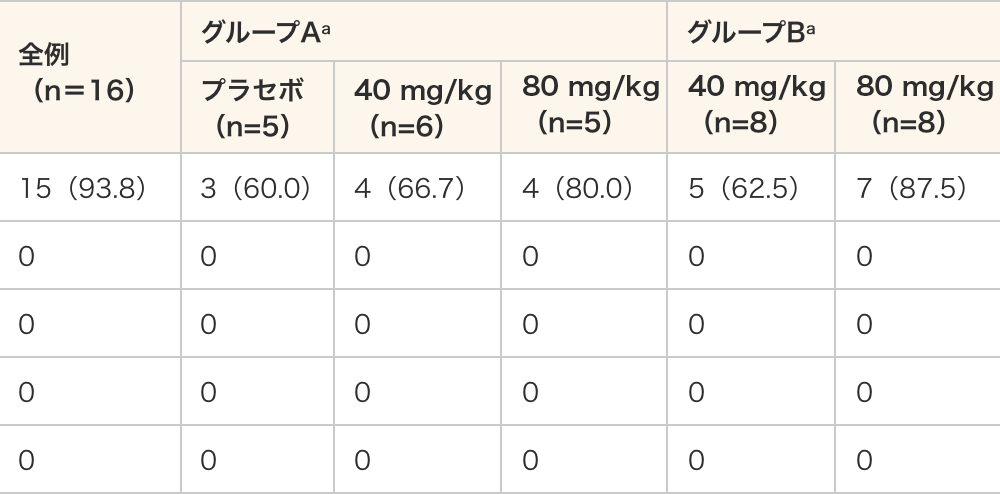
- 本試験において有害事象は、93.8%(15/16例)に認められた。
- 有害事象は全てGrade2以下であり、死亡、重篤な有害事象及び中止に至った有害事象は認められなかった。
- 本試験において副作用は認められなかった。
有害事象のまとめ

全例
(n=16)グループAa グループBa プラセボ
(n=5)40 mg/kg
(n=6)80 mg/kg
(n=5)40 mg/kg
(n=8)80 mg/kg
(n=8)有害事象 15(93.8) 3(60.0) 4(66.7) 4(80.0) 5(62.5) 7(87.5) 治験薬と関連のある有害事象 0 0 0 0 0 0 中止に至った有害事象 0 0 0 0 0 0 重篤な有害事象 0 0 0 0 0 0 死亡例数 0 0 0 0 0 0 - データ表記方法:例数(%)
- 試験治療下で発現した有害事象(TEAE)を有害事象とした。
- 試験期間中に同一被験者に複数の事象が報告された場合は、1例としてカウントした。
- 因果関係は、Not Related(関連なし)、Unlikely(関連ないらしい)、Possible(関連あるかもしれない)、Probable(おそらく関連あり)、Definite(関連あり)の5段階で評価し、Not Related及びUnlikely以外を治験薬との因果関係のあるTEAEとした。
- a:グループAはPeriod1、グループBはPeriod2の被験者数及び割合を要約した。5週時来院の投与より前に発現した事象をグループA解析の対象とし、5週時来院の投与以降に発現した事象をグループB解析の対象とした。
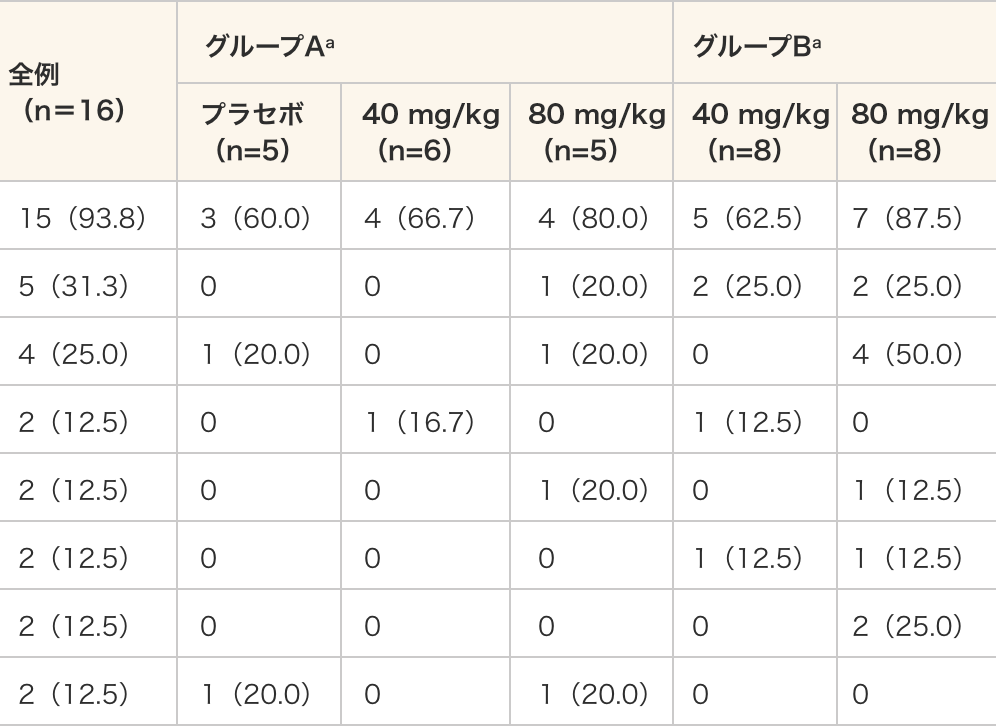
主な有害事象(全例で発現率10%以上の事象を抜粋)

全例
(n=16)グループAa グループBa プラセボ
(n=5)40 mg/kg
(n=6)80 mg/kg
(n=5)40 mg/kg
(n=8)80 mg/kg
(n=8)主な有害事象 15(93.8) 3(60.0) 4(66.7) 4(80.0) 5(62.5) 7(87.5) 咳嗽 5(31.3) 0 0 1(20.0) 2(25.0) 2(25.0) 上咽頭炎 4(25.0) 1(20.0) 0 1(20.0) 0 4(50.0) 鼻閉 2(12.5) 0 1(16.7) 0 1(12.5) 0 挫傷 2(12.5) 0 0 1(20.0) 0 1(12.5) 下痢 2(12.5) 0 0 0 1(12.5) 1(12.5) 嘔吐 2(12.5) 0 0 0 0 2(25.0) 関節痛 2(12.5) 1(20.0) 0 1(20.0) 0 0 - データ表記方法:例数(%)
- 試験治療下で発現した有害事象(TEAE)を有害事象とした。
- 事象名MedDRA/J ver 20.1
- CTCAE(有害事象共通用語基準)ver.4.03に従い評価した。同一カテゴリーで同一の被験者に同じ事象が複数回発現した場合、例数は一番重い程度の事象で集計した。
- a:グループAはPeriod1、グループBはPeriod2の被験者数及び割合を要約した。5週時来院の投与より前に発現した事象をグループA解析の対象とし、5週時来院の投与以降に発現した事象をグループB解析の対象とした。