- トップ
- 製品基本情報ー製品一覧
- ビダーザ®注射用100mg
- 製品情報概要-臨床成績
- 国際共同臨床第Ⅲ相試験(海外データ)
急性骨髄性白血病
臨床成績
国際共同臨床第Ⅲ相試験(海外データ含む)13,14)(ランダム化二重盲検比較試験)
- 13)DiNardo CD, N Engl J Med, 383, pp617-629, 2020
利益相反:本論文の著者にAbbVie社の社員が含まれる。本試験は、AbbVie社及びGenentech社の支援により行われた。 - 14)社内資料:急性骨髄性白血病患者に対するアザシチジンの国際共同臨床第Ⅲ相比較試験(M15-656試験)(承認時評価資料)
試験概要
目的
- 主要目的
- 未治療急性骨髄性白血病患者の生存期間及び複合的完全寛解(完全寛解[CR]+血球数の回復が不完全な完全寛解[CRi]:CR+CRi)率に対するアザシチジン+ベネトクラクス併用投与の有効性と安全性をアザシチジン+プラセボと比較する。
- 副次目的
- 以下の項目についてアザシチジン+ベネトクラクス併用投与の有効性を評価する。
CR率、CR及び部分的血液学的回復(CRh)を伴う完全寛解(CR+CRh)率、サイクル2開始時までの複合的完全寛解(CR+CRi)率、輸血非依存率、微小残存病変(MRD)陰性率、分子マーカーサブグループ別の寛解率及び生存期間、無イベント生存期間(EFS)
対象
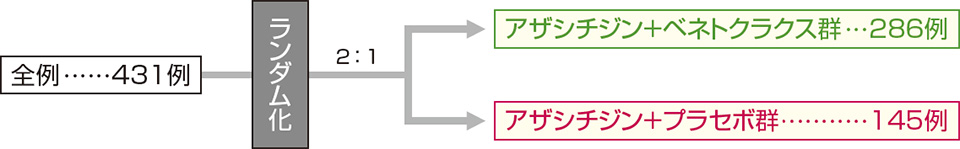
18歳以上で強力な寛解導入療法不適応の未治療急性骨髄性白血病患者431例。
なお、75歳以上ではECOG PS 0〜2、18歳以上74歳以下ではECOG PS 0〜3で、十分な腎機能及び肝機能を有する患者とした。
- 割付
-
年齢(18歳以上74歳以下、75歳以上)、細胞遺伝学的リスク(中程度、不良)及び地域(米国、欧州、中国、日本、その他)を層別因子として、アザシチジン+ベネトクラクス群(併用群)又はアザシチジン+プラセボ群(アザシチジン単独群)のいずれかに2:1の比率でランダム化した。
- 用法及び用量と投与期間
-
アザシチジン:
75mg/m2を1日1回7日間皮下投与又は静脈内投与し、3週間休薬する。これを1サイクルとして投与を繰り返した。ベネトクラクス:
4週間を1サイクルとし、サイクル1の1日目は100mg、2日目は200mg、3日目は400mg、以降400mgで、連日1日1回食後(朝食後が望ましい)30分以内に経口投与した。プラセボ:
ベネトクラクスと同様に経口投与した。アザシチジン、ベネトクラクス及びプラセボは、疾患の増悪、許容できない毒性の発現、同意撤回等が認められるまで投与を継続した。
- 判定基準
-
有効性:IWG判定基準
安全性:治験薬の曝露、有害事象、重篤な有害事象、死亡、並びに臨床検査値及びバイタルサインのパラメータの変化量を評価することで、ベネトクラクス又はプラセボとアザシチジンと併用したときの安全性を評価した。
評価項目
- 主要評価項目:
- 生存期間、複合的完全寛解(完全寛解[CR]+血球数の回復が不完全な完全寛解[CRi])率
- 副次評価項目:
- CR率、CR+部分的血液学的回復を伴う完全寛解(CR+CRh)率、サイクル2開始時までのCR+CRi率及びCR+CRh率、MRD陰性率、無イベント生存期間(EFS)、輸血状況
- 安全性評価項目:
- 有害事象発現率
解析計画
有効性:FAS(ランダム化された全ての被験者)を解析対象集団として、以下の解析を行う。
- 主要評価項目
-
- 生存期間(カプランマイヤー法、層別ログランク検定で投与群間を比較、層別化因子は年齢[18歳以上74歳以下、75歳以上]及び細胞遺伝学的リスク[中間及び予後不良])
- 生存期間のハザード比及び95%信頼区間(層別コックス比例ハザードモデルで推定、層別化因子は年齢[18歳以上74歳以下、75歳以上]及び細胞遺伝学的リスク[中間、不良])
- 主要評価項目及び副次評価項目
-
- CR+CRi率、CR率、CR+CRh率、サイクル2開始時までのCR+CRh率及びCR+CRi率、CR+CRi及びMRD陰性を達成した被験者の割合、輸血非依存となった被験者の割合(層別コクラン・マンテル・ヘンツェル[CMH]検定で投与群間を比較、層別化因子は年齢[18歳以上74歳以下、75歳以上]及び細胞遺伝学的リスク[中間、不良])
- 生存期間について統計学的有意差があった場合にのみ、副次評価項目に対して有意水準0.05(両側)で固定順序法による検定を実施する。
-
以下の通り中間解析を実施する。
- 第1回中間解析を最初の225例がランダム化されてから6ヵ月後の時点で実施し、主要評価項目であるCR+CRi率について有意水準0.01(両側)で検定を行う。第2回中間解析は最大の解析対象集団で死亡が270例に達した時点で実施し、生存期間について評価する。生存期間及び副次評価項目の検定はO’Brien-Fleming(OBF)境界に基づき、第1回中間解析でCR+CRi率に統計学的有意差が認められた場合は、第2回中間解析での生存期間の有意水準はOBF境界に基づき両側0.02とした。
データカットオフ日及び患者の内訳は以下の通りである。
- データカットオフ日は第1回中間解析が2018年10月1日、第2回中間解析が2020年1月4日。
- 第2回中間解析のデータカットオフ時点で、計433例(グループ1*:2例[併用群及びアザシチジン単独群 各1例]、グループ2*:431例[併用群286例、アザシチジン単独群145例])が組み入れられ、そのうち治験薬が投与された被験者は427例(グループ1:2例[併用群及びアザシチジン単独群 各1例]、グループ2:425例[併用群282例、アザシチジン単独群143例])であった。
- 有効性の解析はグループ2の431例を対象とした。
-
*グループ1は初版の治験実施計画書に基づいてランダム化された被験者、グループ2は改訂された治験実施計画書(Amendment 1以降)に基づいてランダム化された被験者である。治験実施計画書 Amendment 1以降では、若年者で強力な寛解導入療法が不適応の被験者も組み入れ可能と変更し、割付け時の層別因子を変更していることから、有効性の解析はグループ2を対象とした。
-
安全性:安全性解析対象集団は、第2回中間解析のデータカットオフ時点(2020年1月4日)までに組み入れられ、治験薬が投与された全ての被験者427例とし、有害事象についてMedDRA version 21.0に従って集計した。
IWG(International Working Group)による血液学的寛解の判定基準
| IWG判定基準 | |
|---|---|
| 完全寛解 Morphologic Complete Remission(CR) |
以下の基準を全て満たす
|
| 血球数の回復が不完全な完全寛解 Morphologic Complete Remission with Incomplete Blood Count Recovery(CRi) |
|
| 部分寛解 Partial Remission(PR) |
CRの血液学的検査値の基準を全て満たすが、骨髄芽球が50%以上減少し、5〜25%である。 |
| 形態学的に白血病細胞がない状態 Morphologic Leukemia-free State(MLFS) |
|
| 治療抵抗 Refractory Disease(RD) |
CR、CRi、PR又はMLFS未達成で、サイクル1の投与終了後7日間以上生存した被験者のみで、血液検査及び/又は骨髄検査で白血病持続の所見が認められる |
| 形態学的再発 Morphologic Relapse(MR) | CR/CRi達成後に末梢血もしくは骨髄中の骨髄芽球が5%以上、又は骨髄外での疾患の発症 |
| 進行 Progressive Disease(PD) |
以下のいずれかを満たす
|
| 部分的血液学的回復を伴う 完全寛解 CR with Partial Hematologic Recovery(CRh) |
|
有効性
アザシチジンの投与サイクル数(中央値)は併用群で7.0サイクル、アザシチジン単独群で4.5サイクル、ベネトクラクス又はプラセボの投与サイクル数(中央値)はそれぞれ7.0サイクル及び4.5サイクルであった(データカットオフ2020年1月4日)。
- 生存期間(主要評価項目)
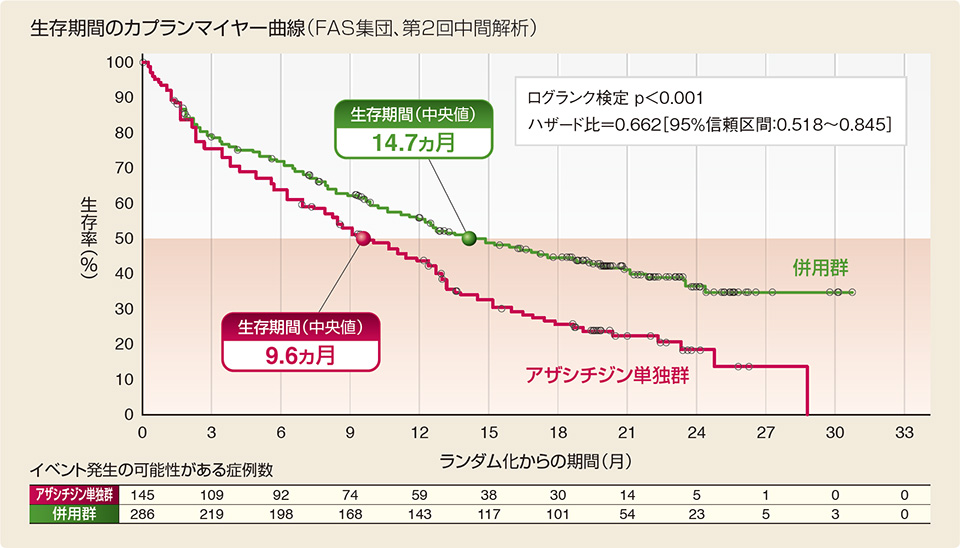
- 生存期間(中央値)は併用群14.7ヵ月(95%信頼区間:11.9〜18.7)、アザシチジン単独群9.6ヵ月(95%信頼区間:7.4〜12.7)であり、併用群で統計学的に有意な生存期間の延長が認められた(ハザード比=0.662、95%信頼区間:0.518〜0.845、p<0.001、層別ログランク検定)。
- 血液学的寛解(主要評価項目、副次評価項目)
- 主要評価項目である第1回中間解析時点(n=226)の寛解(CR+CRi)率は、併用群65.3%(96/147例)(95%信頼区間:57.0〜73.0)、アザシチジン単独群25.3%(20/79例)(95%信頼区間:16.2〜36.4)であり、アザシチジン単独群と比べて併用群で有意に高かった(p<0.001、層別CMH検定)。
副次評価項目である第2回中間解析時点(n=431)の寛解(CR+CRi)率は、併用群66.4%(190/286例)、アザシチジン単独群28.3%(41/145例)であり、アザシチジン単独群と比べて併用群で有意に高かった(p<0.001、層別CMH検定)。
血液学的寛解率(第2回中間解析)
| 併用群(n=286) | アザシチジン単独群(n=145) | ||||
|---|---|---|---|---|---|
| 複合的血液学的寛解(CR+CRi) | 66.4% | 28.3% | |||
| 完全寛解(CR) | 36.7% | 17.9% | |||
| 血球数の回復が不完全な完全寛解(CRi) | 29.7% | 10.3% | |||
| 部分的血液学的回復を伴う完全寛解(CRh) | 28.0% | 4.8% | |||
| 部分寛解(PR) | 1.0% | 2.1% | |||
| 形態学的に白血病細胞がない状態(MLFS) | 8.4% | 4.1% | |||
- MRD陰性率(副次評価項目
- 深い寛解(CR+CRiかつMRD陰性[<10-3])を達成した被験者の割合は、併用群で23.4%(67/286例)、アザシチジン単独群で7.6%(11/145例)であり、アザシチジン単独群と比べて併用群で有意に高かった(p<0.001、層別CMH検定)。
安全性
〈副作用〉
| 併用群 | n=283 |
|---|---|
| 副作用発現 | 246例(86.9%) |
| 主な副作用(発現率15%以上) | |
| 好中球減少症 | 97例(34.3%) |
| 血小板減少症 | 97例(34.3%) |
| 悪心 | 88例(31.1%) |
| 発熱性好中球減少症 | 81例(28.6%) |
| 下痢 | 58例(20.5%) |
| 貧血 | 56例(19.8%) |
| 嘔吐 | 56例(19.8%) |
| 白血球減少症 | 53例(18.7%) |
| 食欲減退 | 43例(15.2%) |
| アザシチジン単独群 | n=144 |
|---|---|
| 副作用発現 | 108例(75.0%) |
| 主な副作用(発現率15%以上) | |
| 血小板減少症 | 37例(25.7%) |
| 悪心 | 35例(24.3%) |
| 好中球減少症 | 31例(21.5%) |
<重篤な有害事象>
| 併用群 | n=283 |
|---|---|
| 重篤な有害事象発現 | 235例(83.0%) |
| 主な重篤な有害事象(発現率10%以上) | |
| 発熱性好中球減少症 | 84例(29.7%) |
| 肺炎 | 47例(16.6%) |
| アザシチジン単独群 | n=144 |
|---|---|
| 重篤な有害事象発現 | 105例(72.9%) |
| 主な重篤な有害事象(発現率10%以上) | |
| 肺炎 | 32例(22.2%) |
| 発熱性好中球減少症 | 15例(10.4%) |
<投与中止に至った有害事象>
| 併用群 | n=283 |
|---|---|
| 投与中止に至った有害事象発現 | 68例(24.0%) |
| 2例以上に認められた投与中止に至った有害事象 | |
| 好中球減少症 | 4例(1.4%) |
| 発熱性好中球減少症 | 4例(1.4%) |
| 血小板減少症 | 4例(1.4%) |
| 敗血症 | 4例(1.4%) |
| 貧血 | 3例(1.1%) |
| 骨髄機能不全 | 3例(1.1%) |
| 血球減少症 | 3例(1.1%) |
| 汎血球減少症 | 3例(1.1%) |
| 心房細動 | 2例(0.7%) |
| 心不全 | 2例(0.7%) |
| 虚血性心筋症 | 2例(0.7%) |
| 心筋梗塞 | 2例(0.7%) |
| アザシチジン単独群 | n=144 |
|---|---|
| 投与中止に至った有害事象発現 | 29例(20.1%) |
| 2例以上に認められた投与中止に至った有害事象 | |
| 好中球減少症 | 5例(3.5%) |
| 発熱性好中球減少症 | 4例(2.8%) |
| 血小板減少症 | 3例(2.1%) |
| 貧血 | 3例(2.1%) |
| 骨髄機能不全 | 2例(1.4%) |
| 血球減少症 | 2例(1.4%) |
死亡に至った有害事象は、併用群では283例中64例(22.6%)に認められた。2例以上に認められた死亡に至った有害事象は、肺炎11例(3.9%)、敗血症6例(2.1%)、死亡4例(1.4%)、心停止、敗血症性ショック、頭蓋内出血及び呼吸不全 各3例(1.1%)、心房細動、多臓器機能不全症候群、全身性炎症反応症候群、腎不全 各2例(0.7%)であった。アザシチジン単独群では144例中、29例(20.1%)に認められた。2例以上に認められた死亡に至った有害事象は、敗血症5例(3.5%)、肺炎3例(2.1%)並びに心停止及び死亡各2例(1.4%)であった。
(データカットオフ2020年1月4日)
9.特定の背景を有する患者に関する注意
9.8 高齢者:患者の状態を観察しながら慎重に投与すること。一般に生理機能が低下していることが多い。
承認された用法及び用量:通常、成人にはアザシチジンとして75mg/m2(体表面積)を1日1回7日間皮下投与又は10分かけて点滴静注し、3週間休薬する。これを1サイクルとし、投与を繰り返す。なお、患者の状態により適宜減量する。(「用法及び用量に関連する注意」については、電子添文をご参照ください。)
- トップ
- 製品基本情報ー製品一覧
- ビダーザ®注射用100mg
- 製品情報概要-臨床成績
- 国際共同臨床第Ⅲ相試験(海外データ)